
分析 根据通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为:2KBr+Cl2═2KCl+Br2,固体质量变化为KBr生成KCl的变化,利用差量法计算NaBr的质量,根据将此残留物再溶于水加入足量的Na2CO3溶液,所得的沉淀为CaCO3,根据CaCl2与Na2CO3反应方程式计算CaCl2的质量,根据总质量减去NaBr和CaCl2的质量即得NaCl的质量.
解答 解:设混和物中NaCl质量为x,KBr质量为y,CaCl2质量为z.
则x+y+z=10.000g
通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为:2KBr+Cl2═2KCl+Br2,固体质量变化为KBr生成KCl的变化,利用差量法计算,
2KBr+Cl2═2KCl+Br2△m
2×119 2×74.5 (119g-74.5g)×2=89g
y (10.000g-9.813g)=0.187g
y=$\frac{0.187g×119×2}{89}$≈0.500g,
将此残留物再溶于水加入足量的Na2CO3溶液,所得的沉淀为CaCO3,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
z 0.721g
z=$\frac{111×0.721g}{100}$=0.800g,
混合物中氯化钠的质量为:10.000g-0.500g-0.800g=8.700g,
答:混合物中含有8.700gNaCl、0.500gKBr和0.800gCaCl2.
点评 本题考查混合物反应的计算,题目难度中等,注意掌握差量法在化学计算中的应用方法,明确发生反应原理为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-向正极移动 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 负极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
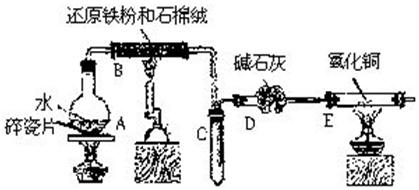
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下反应得产物为Fe2O3和H2 | |
| C. | 在空气中灼烧Fe(OH)3最终得到Fe2O3 | |
| D. | Cl2与过量的铁粉反应生成FeCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com