
以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )
A.锌片溶解了1 mol,铜片上析出1 mol H2
B.两极上溶解和析出的物质质量相等
C.锌片溶解31 g,铜片上析出1 g H2
D.锌片溶解了1 mol,硫酸消耗0.5 mol
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
对化学反应限度的叙述,错误的是()
A. 任何可逆反应都有一定的限度
B. 化学反应达到限度时,正、逆反应速率相等
C. 化学反应的限度与时间的长短无关
D. 化学反应的限度是不可改变的
查看答案和解析>>
科目:高中化学 来源: 题型:
温度t℃时,某NaOH稀溶液中[H+]=10-a mol·L-1,[OH-]=10-b mol·L-1,已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数KW=
________________________________________________________________________。
(2)该NaOH溶液中NaOH的物质的量浓度为
________________________________________________________________________,
该NaOH溶液中由水电离出的[OH-]为__________。
(3)给该NaOH溶液加热,pH________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)____________;在电化学腐蚀中,负极反应是_________________________________________________________________;
正极反应是__________________________________________________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是
________________________________________________________________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是____________________(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、硫酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因________________________________________________________________________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?________。若能,请写出电极反应式,负极:____________________,正极:________________________。(若不能,后两空不填)
(3)设计一种以铁和稀硫酸反应为原理的原电池,要求画出装置图(需标明电极材料及电池的正、负极)。
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。
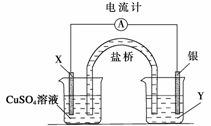
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________;
(2)银电极为电池的__________极,发生的电极反应为______________________;
X电极上发生的电极反应为_______________________________________________;
(3)外电路中的电子是从__________电极流向__________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )
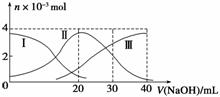
A.H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-
B.当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够成功的是( )
| 选项 | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 | 试样 |
| B | 检验某盐是否为铵盐 | 试样 |
| C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
| D | 除去氯化钠晶体中少量硝酸钾 | 试样
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案合理的是________。
A.配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀恰好溶解
B.在检验醛基配制Cu(OH)2悬浊液时,在一定量CuSO4溶液中,加入少量NaOH溶液
C.验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液
D.无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾,可检验制得的气体是否为乙烯
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.除去混在苯中的少量苯酚,加入过量溴水,过滤
G.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com