
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:分析 (1)Cu元素为29号元素,原子核外有29个电子,根据能量最低原理书写核外电子排布式;原子轨道处于全空、半满或全满时最稳定;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se、SiH4,其分子结构分别与H2O,CH4相似;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价;
(3)SeO2常温下白色晶体,熔、沸点低,为分子晶体;根据价层电子对互斥理论计算杂化类型;
(4)BF3•NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对;
(5)金刚砂(SiC)的硬度为9.5,属于原子晶体;以顶点碳原子研究,与之最近的碳原子处于面心;根据均摊法计算晶胞中C、Si原子数目,用阿伏伽德罗常数表示出晶胞质量,再根据ρ=$\frac{m}{V}$求算密度.
解答 解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,
CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,3d10为稳定结构,所以在高温时,能生成Cu2O,即稳定性是CuO<Cu2O,高温时可以生成Cu2O,
故答案为:1s22s22p63s23p63d104s1;CuO中铜的价层电子排布为3d 94s0,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别V形,正四面体;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si,
故答案为:V形、正四面体;>;
(3)SeO2常温下白色晶体,熔、沸点低,为分子晶体,二氧化硒分子中价层电子对=2+$\frac{1}{2}$(6-2×2)=3,Se原子的杂化类型为sp2,
故答案为:分子晶体;sp2;
(4)BF3•NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键,
故答案为:sp3;配位;
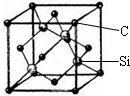
(5)金刚砂(SiC)的硬度为9.5,属于原子晶体,以顶点碳原子研究,与之最近的碳原子处于面心,所以每个C原子周围最近的C原子数目为$\frac{3×8}{2}$=12,
该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞质量为4×$\frac{28+12}{{N}_{A}}$g,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,其密度=4×$\frac{28+12}{{N}_{A}}$g÷(a×10-10cm)3=$\frac{4×40}{{N}_{A}×(a×1{0}^{-10})^{3}}$g/cm3,
故答案为:原子;12;$\frac{4×40}{{N}_{A}×(a×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、空间构型与杂化方式判断、晶体类型与性质、晶胞计算等,掌握均摊法进行晶胞的有关计算,需要学生具备扎实的基础.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:推断题
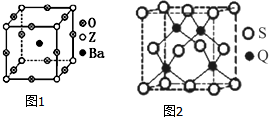 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
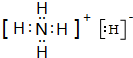 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
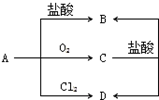 已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:
已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
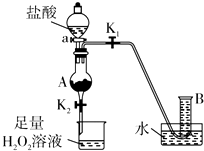 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
. .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
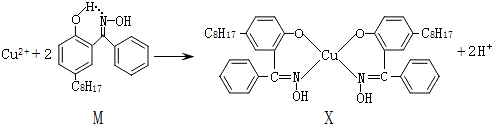
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com