
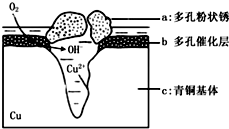
 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )
如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法正确的是( )| A. | 腐蚀过程中,负极是 b 和 c | |
| B. | 生 成 Cu 2( OH )3 Cl 的 离子方程式为:2Cu2++3OH -═Cu 2( OH ) 3+ | |
| C. | 若生成 4.29gCu 2( OH )3 Cl,则理论上消耗标准状况氧气体积为0.448L | |
| D. | 正极的电极反应式为:O 2-4e-+2H+═2OH - |
分析 A、根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化;
B、多孔粉状锈 Cu2 ( OH )3 Cl为固体,不能拆;
C、n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积;
D、氧气得电子生成氢氧根离子.
解答 解:A、根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化,腐蚀过程中,负极是c,故A错误;
B、多孔粉状锈 Cu2 ( OH )3 Cl为固体,故生 成 Cu 2( OH )3 Cl 的 离子方程式为:2Cu2++3Cl-+3OH-═Cu 2( OH )3Cl,故B错误;
C、n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,故在标准状态体积为V=0.02mol×22.4L/mol=0.448L,故C正确;
D、氧气在正极得电子生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,故D错误;
故选C.
点评 本题考查了原电池原理及电极反应式、电池反应式的书写及其计算,难度中等,掌握原理是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 目前元素周期表有7个周期 | B. | 元素周期表有8个主族 | ||
| C. | ⅢA族元素全部是金属元素 | D. | 非金属元素都在ⅣA~ⅤⅡA和0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 23:24:37 | C. | 23:12:9 | D. | 36:69:92 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
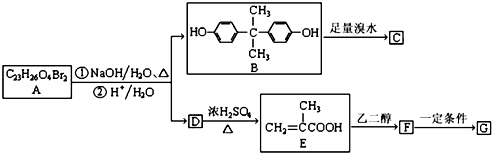
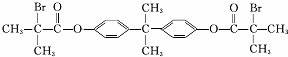
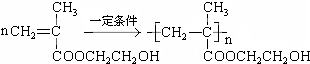 .
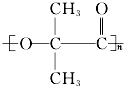
.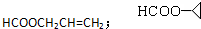 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
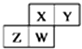 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| C. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com