
| A. | 单质的熔沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 相同条件下,单质的密度逐渐变小 | D. | 单质的颜色逐渐加深 |
分析 由元素周期律可知,卤族元素从上到下,得电子能力逐渐减弱,气态氢化物稳定性逐渐减弱,金属性逐渐增强,单质氧化性逐渐减弱,单质的颜色加深,以此来解答.
解答 解:A.均为分子构成的物质,相对分子质量大的沸点大,则随着卤素原子半径的增大,单质的熔沸点逐渐增大,故A错误;
B.卤族元素从上到下,得电子能力逐渐减弱,则单质的氧化性逐渐减弱,故B错误;
C.相同条件下,随着卤素原子半径的增大,单质的密度逐渐增大,故C错误;
D.卤族元素从上到下,随着卤素原子半径的增大,单质的颜色逐渐加深,故D正确;
故选D.
点评 本题考查卤素的性质,为高频考点,把握同主族元素及单质的性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积 V(mL) |
| 1 | 22.4 | 10.00 |
| 2 | 22.60 | 10.00 |
| 3 | 26.00 | 10.00 |
| 4 | 22.50 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
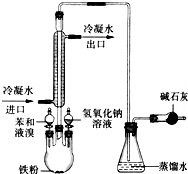 如图是实验室制取溴苯的装置图.
如图是实验室制取溴苯的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33.35 | -164 |
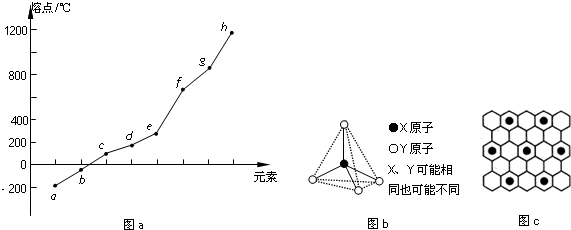
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1醋酸溶液与 0.1 mol•L-1醋酸溶液中c(H+)之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)和c(SO42-)的物质的量浓度之比 | |
| C. | pH=2的盐酸和pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比 | |
| D. | 0.2 mol/LCH3COONa溶液与 0.1 mol•L-1Na2CO3溶液中c(CH3COO-)与c(CO32-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | 6 | 7 | ||||||
| 3 | 1 | 3 | 5 | 8 | 10 | |||
| 4 | 2 | 4 | 9 |
 H++Cl-+HClO.
H++Cl-+HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| B. | 同一主族的两种元素的原子序数之差可能是44 | |
| C. | 卤素单质随原子序数的增大,其熔沸点逐渐降低 | |
| D. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com