
分析 (1)已知:①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=akJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=bkJ/mol
根据盖斯定律,①+②×2可得:2CH4(g)+O2(g)=2CH3OH(g);
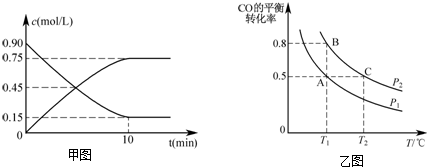
(2)随反应进行,CO浓度减小、甲醇浓度增大,由图可知,10min到达平衡,CO浓度变化为(0.9-0.15)mol/L=0.75mol/L,再根据v=$\frac{△c}{△t}$计算v(CO);
化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(3)①可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
②温度一定时,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大;
③A、B温度相同,平衡常数相同,若达到化学平衡状态A时,容器的体积为20L,CO转化率为50%,则转化的CO为10mol×50%=5mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{5}{20}}{\frac{5}{20}×(\frac{10}{20})^{2}}$=4,
计算B状态时各组分物质的量,再结合平衡常数计算体积;
(4)①原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水;
②当有0.75mol甲醇参与反应时,产生的二氧化碳是0.75mol,和1mol氢氧化钾反应,根据元素守恒:n (K2CO3)+n (KHCO3)=0.75mol,2n (K2CO3)+n(KHCO3)=1mol,联立解得:n (K2CO3)=0.25mol,n (KHCO3)=0.5mol,溶液呈碱性,且水解程度不大.
解答 解:(1)已知:①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=akJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=bkJ/mol
根据盖斯定律,①+②×2可得:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,
故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
(2)随反应进行,CO浓度减小、甲醇浓度增大,由图可知,10min到达平衡,CO浓度变化为(0.9-0.15)mol/L=0.75mol/L,则v(CO)=$\frac{0.75mol/L}{10min}$=0.075mol•L-1•min-1;
CO(g)+2H2(g)═CH3OH(g)的化学平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,
故答案为:0.075mol•L-1•min-1;$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;
(3)①A.H2的消耗速率等于CH3OH的生成速率的2倍,均表示正反应速率,反应始终按该比例关系进行,不能说明到达平衡,当H2的消耗速率等于CH3OH的消耗速率的2倍时,反应到达平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.氢气、CO的转化率与它们起始物质的量有关,平衡时不一定相等,若起始物质的量之比等于化学计算量之比,转化率始终相等,故C错误;
D.混合气体总质量不变,随反应进行,混合气体总物质的量减小,平均摩尔质量增大,混合气体气体的平均摩尔质量不再改变,说明达到了平衡,故D正确.
故选:AC;
②温度一定时,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大,故压强PA<PB,
故答案为:<;
③若达到化学平衡状态A时,容器的体积为20L,CO转化率为50%,则转化的CO为10mol×50%=5mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{5}{20}}{\frac{5}{20}×(\frac{10}{20})^{2}}$=4,
如果反应开始时仍充入10molCO和20molH2,在平衡状态B时CO转化率为80%,则转化的CO为10mol×80%=8mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):10 20 0
变化量(mol):8 16 8
平衡量(mol):2 4 8
设体积为VL,则$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=4,解得V=4,
故答案为:4;
(4)①原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②当有0.75mol甲醇参与反应时,产生的二氧化碳是0.75mol,和1mol氢氧化钾反应,根据元素守恒:n (K2CO3)+n (KHCO3)=0.75mol,2n (K2CO3)+n(KHCO3)=1mol,联立解得:n (K2CO3)=0.25mol,n (KHCO3)=0.5mol,溶液呈碱性,溶液中各种离子的物质的量浓度由大到小的顺序是:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查化学平衡计算、平衡状态判断、盖斯定律应用、原电池、离子浓度大小比较,题目比较综合,需学生具备扎实的基础,是对学生综合能力的考查,(3)中体积计算为难点,注意掌握平衡常数应用,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:多选题
| 选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
| A | 碘水 | 四氯化碳 萃取 | 分液漏斗 |
| B | 一氧化碳(二氧化碳) | 澄清石灰水 洗气 | 洗气瓶 |
| C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
| D | 乙醇(水) | 生石灰 蒸馏 | 蒸馏烧瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:
某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和32gO3所含分子数目都为NA | |
| B. | 标准状况下,11.2 L水中含有的原子数是1.5NA | |
| C. | 0.1mol Fe参与化学反应转移的电子数一定为0.3NA | |
| D. | 标准状况下,5.6L氯气和16.8L氧气混合气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1 528.6 kJ•mol-1 | B. | +1 220 kJ•mol-1 | ||
| C. | -1220 kJ•mol-1 | D. | +1 528.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成16 mol N2转移30 mol电子 | |
| B. | NaN3中N元素被还原 | |
| C. | N2既是氧化剂又是还原剂 | |
| D. | 还原产物与氧化产物质量之比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 AX(g)+2X2(g)?AX5(g)在容积为10L恒定不变的密闭容器中进行.起始时AX和X2均为1.3mol.分三组进行实验,每组只改变一个条件且改变条件均不同.反应体系总压强随时间的变化如图所示.(计算结果均保留两位有效数字)
AX(g)+2X2(g)?AX5(g)在容积为10L恒定不变的密闭容器中进行.起始时AX和X2均为1.3mol.分三组进行实验,每组只改变一个条件且改变条件均不同.反应体系总压强随时间的变化如图所示.(计算结果均保留两位有效数字)查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com