
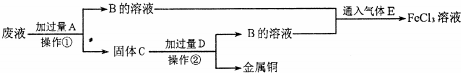
分析 反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣C中含有金属铜,故应是废液与过量的Fe反应,滤液B中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣C中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液B通入氯气,进而生成氯化铁,以此解答该题.
解答 解:反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣C中含有金属铜,故应是废液与过量的Fe反应,滤液B中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣C中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液B通入氯气,进而生成氯化铁,
(1)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,
故答案为:KSCN溶液;溶液变为红色;
(2)操作①用于分离和固体,为过滤操作,固体C为Fe、Cu的混合物,故答案为:过滤;Fe、Cu;
(3)废液加入过量铁反应和铁离子反应生成亚铁离子,反应的离子方程式:Fe+2Fe3+=3Fe2+,向B的溶液中滴加NaOH溶液生成氢氧化亚铁,反应现象为产生白色沉淀,迅速变为灰绿色,最终变为红褐色,
故答案为:Fe+2Fe3+=3Fe2+;产生白色沉淀,迅速变为灰绿色,最终变为红褐色;
(4)氯气具有氧化性,能将亚铁离子氧化为三价铁,实质是:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查了化学工艺流程、常用化学用语、元素化合物性质等知识,为高频考点,题目难度不大,掌握元素化合物的性质是关键,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可以改变化学反应的反应热 | |
| B. | 等物质的量的Al、Fe与足量的盐酸反应电子转移的量相同 | |
| C. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液Fe(OH)3胶体>FeCl3溶液 | |
| D. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a放出的热量比途径b多 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{高温}^{O_{2}}$CO2+H2O 途径b:C$→_{高温}^{O_{2}}$CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉变质后的残留固体有碳酸钙 | |
| B. | 实验室可用浓硫酸干燥硫化氢 | |
| C. | 将稀氨水滴到氢氧化钠溶液中可以制取氨气 | |
| D. | 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验方案 | 实验结果 |
| A | 将SO2气体依次通过NaHCO3溶液、溴水、品红溶液、澄清石灰水 | 品红无变化,澄清石灰水变浑浊 |
| B | 将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体通入澄清石灰水 | 澄清石灰水变浑浊 |
| C | 取相同体积、相同物质的量浓度的NaHSO3与Na2CO3溶液,分别加入等体积、等浓度的少量盐酸 | 前者产生气体体积大于后者的 |
| D | 分别配置SO2和CO2的饱和溶液,立即测定两种饱和液的pH | 前者的pH小于后者的 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸反应CO32-+2H+═CO2↑+H2O | |
| B. | 稀硫酸与氯化钡溶液反应Ba2++SO42-═BaSO4 | |
| C. | 氢氧化镁与稀硫酸反应OH--+H+═H2O | |
| D. | 铁钉放入硫酸铜溶液中2Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X单质、Y单质工业上均用电解其氧化物法得来 | |
| B. | Z、W两元素形成的不同化合物,Z的化合价一定不同 | |
| C. | Y的氧化物能与酸反应也能与碱反应,所以既是酸性氧化物又是碱性氧化物 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
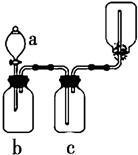 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )
下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )| 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A. | A | B. | B | ||
| C. | C D.D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com