
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的氧化剂是_____,还原剂是____,每生成1molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用:_________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。写出并配平湿法制备高铁酸钾的离子反应方程式:______________。
【答案】Na2O2 FeSO4、Na2O2 5 高铁酸钾具有强氧化性,能杀菌消毒,且消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉降 2Fe(OH)3+3ClO-+4OH-=2FeO42—+3Cl-+5H2O
【解析】
(1)①氧化剂中元素得电子化合价降低,还原剂中元素失去电子化合价升高,根据氧化还原反应的规律找出电子转移数;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且在溶液中会生成胶体,具有吸附性,据此分析作答;
(2)根据氧化还原反应的配平原则进行配平。
(1)①2FeSO4+6Na2O2=2NaFeO4+2Na2O+2Na2SO4+O2↑中Fe元素的化合价升高,过氧化钠中O元素的化合价既升高又降低,则氧化剂为Na2O2,还原剂为FeSO4和Na2O2,由反应方程式可知,2NaFeO4![]() 10e-,故每生成1molNa2FeO4转移的电子数为
10e-,故每生成1molNa2FeO4转移的电子数为![]() =5mol,故答案为:Na2O2;FeSO4、Na2O2;5;
=5mol,故答案为:Na2O2;FeSO4、Na2O2;5;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解生成氢氧化铁胶体,胶体具有吸附性能吸附除去水中的悬浮杂质,本题答案为:高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解成Fe(OH)3胶体能吸附水中悬浮杂质而沉淀;
(2)湿法制备高铁酸钾(K2FeO4),结合物质的性质可知,氢氧化铁被氧化,该离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42—+3Cl-+5H2O。


科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光,装置如图。下列说法错误的是![]()
![]()
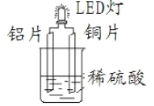
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将铝片换成银片,电路中的电流方向相反
D.如果将硫酸换成NaOH溶液,LED灯也会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向Na2CO3溶液中逐滴滴入0.1mol·L-1盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是( )

A.a点时溶液pH=11.5,原因是:CO32—+2H2O===H2CO3+2OH-
B.a~b段发生反应为:CO32—+2H+===CO2↑+H2O
C.b~c段发生反应为:HCO3—+H+===CO2↑+H2O
D.c~d段发生反应为:H++OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏 1 mol 氢气中的化学键消耗的能量为 ![]() kJ,破坏 1 mol 氯气中的化学键消耗的能量为
kJ,破坏 1 mol 氯气中的化学键消耗的能量为![]() kJ,形成 1 mol 氯化氢中的化学键释放的能量为
kJ,形成 1 mol 氯化氢中的化学键释放的能量为 ![]() kJ, 下列关系式中正确的是 ( )
kJ, 下列关系式中正确的是 ( )
A.![]() +
+![]() >
>![]() B.
B.![]() +
+![]() <
<![]() C.
C.![]() +
+![]() <2
<2![]() D.
D.![]() +
+![]() >2
>2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、W是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。W是第四周期d区原子序数最大的元素。请回答下列问题:
(1)填元素名称, C:________写出E的价层电子排布式_________,W在周期表中的位置:___________________
第二周期基态原子未成对电子数与W相同且电负性最小的元素是________(填元素符号).
(2)W(BD)n为无色挥发性剧毒液体,熔点﹣25℃,沸点43℃.不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,W(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,BD分子的结构式是________
(3)3﹣氯﹣2﹣丁氨酸的结构简式为:![]() ,一个该有机物分子中含有_____个手性碳原子.
,一个该有机物分子中含有_____个手性碳原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铜和浓硫酸的反应,下列装置或操作错误的是
甲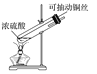 乙
乙 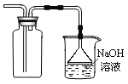 丙
丙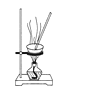
A.上下移动装置甲中的铜丝可控制SO2的生成
B.装置乙可用于收集SO2气体
C.为确认甲中有CuSO4生成,向甲中反应后的试管中直接加水稀释,观察溶液颜色
D.利用装置丙将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a An+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A. 原子序数:b>a>c>dB. 最高价氧化物对应水化物的碱性:B>A
C. 四种离子的电子层结构相同,因而离子的性质也相同D. 气态氢化物的稳定性:D>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com