
| A. | 新制氯水可使蓝以石蕊试纸先变红,后褪色 | |
| B. | 新制氯水中只含有Cl2和H2O分子 | |
| C. | 氯水放置数天后,酸性增强 | |
| D. | 光照氯水有气泡逸出,该气体是Cl2 |
分析 氯气与水发生:Cl2+H2O?HCl+HClO,HCl为强酸,完全电离,HClO具有弱酸性部分电离、HClO具有强氧化性、漂白性以及不稳定性,氯水中含有Cl2、HClO和H2O等分子.
解答 解:A.氯气与水发生:Cl2+H2O?HCl+HClO,HCl、HClO电离出的氢离子可使蓝色石蕊试纸先变红,HClO可使蓝色石蕊试纸褪色,故A正确;
B.氯气与水发生:Cl2+H2O?HCl+HClO,HClO为弱酸,氯水中含有Cl2、HClO和H2O等分子,故B错误;
C.HClO不稳定,分解生成HCl,氯水放置数天后,酸性增强,溶液pH减小,故C正确;
D.HClO不稳定,见光分解,发生:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,生成氧气,故D错误;
故选AC.
点评 本题考查氯水的成分及性质,题目难度不大,注意次氯酸的弱酸性和漂白性.


科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:计算题
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(1)若某可逆反应的化学平衡常数表达式为:K=C(CO)·C(H2)/C(H2O)
写出该反应的化学方程式:_____________________。
(2) CO(g)+H2O(g) CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状
CO2(g)+H2(g)△H<0在427℃时将CO和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状 态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
态,该反应的平衡常数是9,则CO的转化率是多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中H2SO4的物质的量浓度为18.4mol/L.
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中H2SO4的物质的量浓度为18.4mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
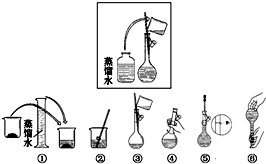 某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.
某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA | |
| B. | 32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| C. | 物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA | |
| D. | 1molD3${\;}_{\;}^{18}$O+(其中D代表${\;}_{1}^{2}$H)中含有的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其溶液中的c(OH-)=0.1mol•L-1 | |
| B. | 加水稀释后,水电离出的c(OH-)变大 | |
| C. | 加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| D. | 与AlCl3溶液发生反应的离子方程式为:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
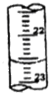 某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加入铜粉,再加入KNO3固体 | |
| B. | SO2通入Ba(NO3)2溶液中 | |
| C. | CO2通入CaCl2溶液中 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com