
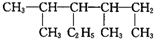 系统法命名:2,4-二甲基-3-乙基己烷.
系统法命名:2,4-二甲基-3-乙基己烷. 分析 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中,只有Cu2O具有还原性,与硝酸发生14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,反应中Cu元素化合价由+1价升高到+2价,N元素化合价由+5价降低到+2价;
高锰酸钾具有强氧化性,可与二氧化硫、乙烯、乙醛、甲苯等发生氧化还原反应;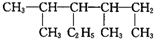 主链有6个C原子,含有2个甲基、1个乙基,以此解答该题.
主链有6个C原子,含有2个甲基、1个乙基,以此解答该题.
解答 解:(1)要使硝酸根离子发生还原反应,则需要加入还原剂,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中KMnO4、Fe2(SO4)3具有强氧化性,Na2CO3没有氧化性和还原性,Cu2O有还原性,所以能使硝酸根离子发生还原反应的是Cu2O,二者反应生成硝酸铜、NO和水,反应方程式为14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,
故答案为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;
(2)反应中若产生0.2mol气体,则转移电子的数=0.2mol×(5-2)×NA/mol=0.6NA,故答案为:0.6NA;
(3)3mol Cu2O参加反应失去6mol电子,N元素化合价由+5价降低到+2价,则亚铜离子还原的HNO3的物质的量为$\frac{6mol}{5-2}$=2mol,故答案为:2;
(4)SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应生成SO42-和Mn2+离子,反应的方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,
故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(5)乙烯含有碳碳双键,裂化汽油含有不饱和烃,可被高锰酸钾氧化,乙醛含有醛基,可被酸性高锰酸钾氧化,故答案为:ADE;
(6)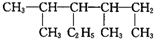 主链有6个C原子,含有2个甲基、1个乙基,名称为2,4-二甲基-3-乙基己烷,故答案为:2,4-二甲基-3-乙基己烷.
主链有6个C原子,含有2个甲基、1个乙基,名称为2,4-二甲基-3-乙基己烷,故答案为:2,4-二甲基-3-乙基己烷.
点评 本题考查较为综合,涉及氧化还原反应、二氧化硫、有机物的名称等知识,为高频考点,侧重于学生的分析、计算能力的考查,注意相关知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 两元素形成的最高价氧化物水化物的酸性A强于B | |
| B. | A的气态氢化物比B的气态氢化物稳定 | |
| C. | A的金属性比B的金属性强 | |
| D. | A的阴离子比B的阴离子还原性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | |
| B. | 苯乙烯分子中所有原子不可能共平面 | |
| C. | 甲苯中最多有13个原子共平面 | |
| D. | 丙烯分子中最多有6个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3的方法冶炼Al | |
| B. | 灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液中,则放出氢气的体积(同温同压下)不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
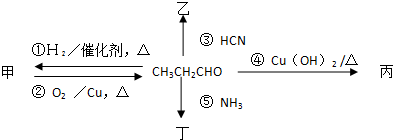
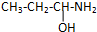
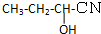
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com