
分析 (1)32g的CH3OH的物质的量为1mol,结合盖斯定律计算;
(2)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律②+③+①×2解答.
解答 解:(1)①CH3OH(g)+$\frac{3}{2}$O2=CO2(g)+2H2O(g)△H=-192.9KJ/mol,②H2O(l)=H2O(g)△=44KJ/mol,
利用盖斯定律将①-②×2可得CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O
△H=(-192.9kJ/mol)-44KJ/mol×2=-280.9kJ/mol,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol;
(2)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律②+③+①×2得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1,故答案为:-246.4kJ•mol-1.
点评 本题主要考查了盖斯定律应用为高频考点,侧重于学生的分析、计算能力的考查,把握盖斯定律的应用,为解答该题的关键,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 难氧化 | B. | 难溶于水 | C. | 属于硅酸盐 | D. | 属于混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应H++OH-═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙跟盐酸反应CaCO3+2HCl═2Ca++H2CO3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
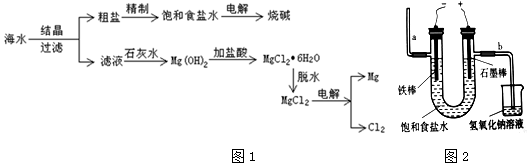
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
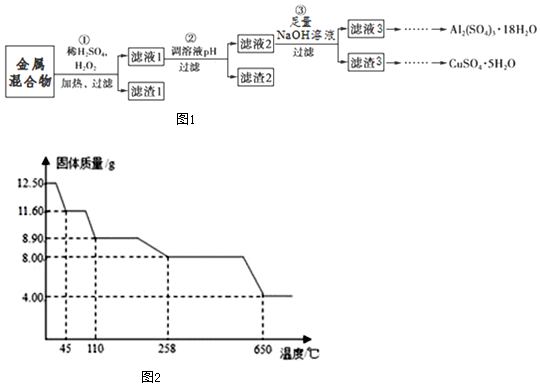
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com