
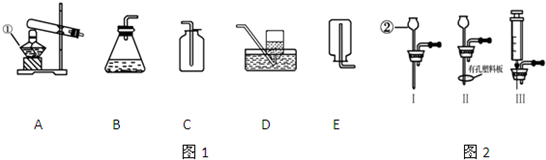


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
| A、浓硫酸具有吸水性,可用作干燥剂 |
| B、浓硝酸与铁不反应,可用铁桶贮存浓硝酸 |
| C、硅可作半导体材料,是光导纤维的主要成分 |
| D、SO2能使含有酚酞的NaOH溶液褪色,说明SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,这是21世纪具有广阔前景的合成材料.
,这是21世纪具有广阔前景的合成材料.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
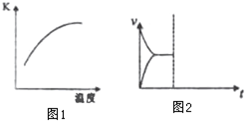 科学家一直致力于“人工固氮”的新方法研究.
科学家一直致力于“人工固氮”的新方法研究.| v(N2) |
| v(O2) |
| c(OH-) |
| c(NH3?H2O) |
| c(H+) |
| c(OH-) |
| m |
| n |
| m |
| n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com