
 某温度下,NH3?H2O的电离常数为1.6×10-5,将1.000mol?L-1的盐酸逐滴滴入20.00mL 1.000mol?L-1氨水中,溶液的pH和温度随加入盐酸体积变化曲线如图所示,下列有关说法不正确的是( )
某温度下,NH3?H2O的电离常数为1.6×10-5,将1.000mol?L-1的盐酸逐滴滴入20.00mL 1.000mol?L-1氨水中,溶液的pH和温度随加入盐酸体积变化曲线如图所示,下列有关说法不正确的是( )| A、a点:溶液的pH约为12.6 | B、b点:c(NH 4+)>c(Cl-)>c(OH-)>c(H+) | C、c点:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
|


科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
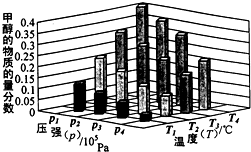 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com