
【题目】不同元素的原子电负性不同,若用x值来表示,x值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的电负性的值:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
第二周期 | Li | Be | B | C | N | O | F |
电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
第三周期 | Na | Mg | Al | Si | P | S | Cl |
电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值的变化规律,确定N、Mg的x值的范围:<x(Mg)< , <x(N)< .
(2)推测x值与原子半径的关系是 . 根据短周期元素x值变化特点,体现了元素性质的变化规律.
(3)某有机物结构简式如图,其中C﹣N中,你认为共用电子对偏向原子(填原子名称). 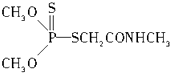
(4)经验规律告诉我们,当成键的两原子的x差值,即△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键的类型为
(5)预测元素周期表中x值最小的元素是(填元素符号,放射性元素除外).
【答案】
(1)0.93;1.57;2.55;3.44
(2)同周期(或同主族)元素,x值越大,原子半径越小;周期性
(3)氮
(4)共价键
(5)Cs
【解析】解:(1)由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化,故:0.93<x(Mg)<1.57,2.55<x(N)<3.44, 故答案为:0.93;1.57;2.55;3.44;(2)由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下原子半径增大,而x值减小,x值的变化体现周期性的变化,故答案为:同周期(或同主族)元素,x值越大,原子半径越小;周期性;(3)由于N的电负性等于碳的,故中C﹣N中共用电子对偏向氮原子,故答案为:氮;(4)由变化规律可知,Br的x值小于3.16,AlBr3中,Al元素与Br元素的△x<3.16﹣1.61=1.55<1.7,故AlBr3中化学键类型为共价键,故答案为:共价键;(5)同一周期周期从左到右,元素的x值最大,同一主族从上到下,x值逐渐减小,则x值最小的元素应位于周期表的左下角,排除放射性元素,应为Cs元素,故答案为:Cs.
(1)(2)题中给出的x值与吸引电子的能力有关,可根据元素周期性变化来推测Mg和N的x值,由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化;(3)电负性越大,对键合电子吸引越强;(4)由变化规律可知,Br的x值小于3.16,而△x>1.7时一般为离子键,当△x<1.7时一般为共价键;(5)同周期自左而右x值增大,同主族自上而下x减小.


科目:高中化学 来源: 题型:
【题目】有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分.某化学兴趣小组为验证其组成元素,进行了如下实验:将少量样品放入A的燃烧管中,通入足量O2 , 用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置.(夹持仪器的装置已略去) 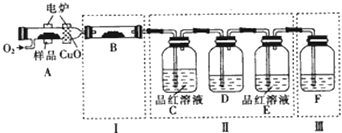
(1)写出A中样品燃烧的化学方程式: .
(2)装置B的目的是验证有机物中含氢元素,则B中盛装的试剂为 .
(3)D中盛放的试剂是(填字母). a.NaOH溶液 b.品红溶液 c.KMnO4溶液 d.饱和石灰水
(4)能证明有机物含碳元素的现象是 .
(5)燃烧管中放入CuO的作用是 .
(6)请指出装置F中的错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示: 
(1)请列举海水淡化的一种方法 .
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、、 .
(3)步骤Ⅰ中已经获得Br2 , 步骤Ⅱ中又将获得的Br2还原为Br﹣ , 其目的是
(4)步骤Ⅱ用SO2水溶液吸收Br2 , 吸收率可达95%,该反应的离子方程式为 . 由此反应可知,除保护环境外,在工业生产中还应解决的问题是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海争端、南海仲裁案一直牵动国人的心,南海是一个巨大的资源宝库,海水开发利用的部分过程如下图所示.下列有关说法正确的是( ) 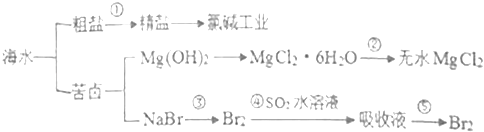
A.第①步中除去粗盐中的SO42﹣、Ca2+、Mg2+等杂质,加入药品的顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液、过滤后加盐酸
B.第②步的关键要低温小火烘干
C.氯碱工业的阴极产物是Cl2
D.第③步到第⑤步的目的是为了富集溴元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( ) 
A.2H2+O2 ![]() 2H2O
2H2O
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.CuO+CO ![]() Cu+CO2
Cu+CO2
D.Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值,下列说法正确的是( )
A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023
B.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C.0.1molNa2O2与足量二氧化碳充分反应转移的电子数为0.2NA
D.0.1molFe在0.1mol氯气中燃烧,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对原子核外电子以及电子的运动,下列描述正确的是( ) ①可以测定某一时刻电子在原子中所处的位置
②电子质量很小且带负电荷
③电子在原子里有“广阔”的运动空间
④运动速度接近光速
⑤与宏观物体一样有固定的运动轨道
⑥现代最先进的扫描隧道显微镜也观察不到电子的运动.
A.①②③⑥
B.②③④⑥
C.③④⑤⑥
D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯及芳香烃的认识是一个不断深化的过程. 请回答下列:
(1)1866年凯库勒根据苯的分子式C6H6提出了苯的单键,双键交替的正六边形平面结构,解释了苯的部分性质,但有一些问题仍未能解决. ①凯库勒结构不能解释的事实是(填序号)
A.苯能与氢气发生加成反应
B.苯不能使溴的四氯化碳溶液褪色
C.溴苯没有同分异构体
D.邻二溴苯只有一种结构
②现已发现C6H6还能以如图所示的结构形式存在(各边和棱均代表碳碳单键).该结构的二氯代物有种.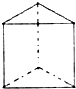
(2)苯和甲苯不容易与溴水发生加成反应,而易与溴单质发生取代反应.写出下列反应的化学方程式: ①苯与溴单质发生取代反应 .
②甲苯与浓硫酸和浓硝酸的混酸发生取代反应 .
(3)苯乙烯在常温下用镍做催化剂与氢气加成得到乙苯,很难得到乙苯环乙烷,这说明: .
(4)苯不易被氧化,而烯烃和炔烃却容易被酸性高锰酸钾溶液氧化,反映出苯中的碳碳键与烯烃和炔烃不同.某烃的分子式为C11H20 , 1mol该烃在催化剂的作用下可以吸收2molH2;用酸性高锰酸钾溶液氧化,得到丁酮( ![]() )、丙酮和琥珀酸(HOOC﹣CH2CH2﹣COOH)的混合物,该烃的结构简式是 .
)、丙酮和琥珀酸(HOOC﹣CH2CH2﹣COOH)的混合物,该烃的结构简式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com