
| A. | 只有(1)(2) | B. | 只有(1)(2)(3) | C. | 只有(4)(5) | D. | 全不正确 |
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:4:9 | C. | 1:9:6 | D. | 1:6:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水 | B. | 配置500 mL 0.5 mol/L NaCl溶液 | ||
| C. | 除去CaCO3中混有的少量NaCl | D. | 分离食盐水和CCl4的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
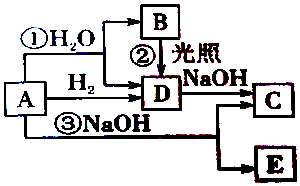
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol | B. | 0.15mol | C. | 0.2mol | D. | 0.215mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com