
����Ŀ��2017��3��21���ǵڶ�ʮ���������ˮ����������ˮ��Դ���������÷�ˮ��ʡˮ��Դ����ǿ��ˮ�Ļ��������ѱ�Խ��Խ���������ע����֪��ij��ɫ��ˮ�п��ܺ���H����NH4+��Fe3����Al3����Mg2����Na����NO3-��CO32-��SO42-�еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������й�ͼ��������ʾ��
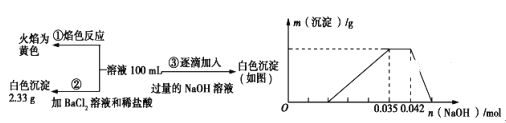
��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������__________��һ�����ڵ���������______________________��
��2��д��ʵ���ͼ���г����ﵽ��������������ٷ����仯�η�����Ӧ�����ӷ�Ӧ����ʽ��_____________________________________________��
��3������ͼ����ԭ��Һ��c(NH4+)��c(Al3��)�ı�ֵΪ___________�����ó��������������_________g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c(Na��)=0.14 mol��L-1,���ж�ԭ��ˮ��NO3-�Ƿ���ڣ�__________����������������������������ȷ�������������ڣ�c(NO3-)=____________ mol��L-1�����������ڻ�ȷ����˿ղ��
���𰸡� CO32- Na+��H+��Al3+��NH4+ NH4+ + OH�� = NH3��H2O 1��1 0.546g ���� 0.36 mol��L-1
��������(1)��ɫ��ˮȷ����Fe3+������ʵ���ȷ����Na+������ʵ���ȷ����SO42-������ʵ���ȷ����Al3+��һ������Fe3+��Mg2+����ΪCO32-��Al3+���ܹ��棬������CO32-������Һ�д��ڵ�����Ϊ��Na+��Al3+��NH4+��H+��SO42-����ˮ��һ�������ڵ�������Fe3+��Mg2+��CO32-���ʷ�ˮ��һ�������ڵ���������CO32-��һ�����ڵ���������Na+��Al3+��NH4+��H+��
(2)ʵ���ͼ���г����ﵽ������������μ�NaOH��Һ������Һ���NH4+ ��������NH3��H2O����ʱ�����������ٷ����仯����Ӧ�����ӷ�Ӧ����ʽNH4+ + OH�� = NH3��H2O��
(3)��֪���ᱵ����Ϊ2.33g����n(SO42-)=![]() =0.01mol��
=0.01mol��
����ͼ���֪��Al(OH)3��Ӧ��OH-Ϊ��n(OH-)=0.007mol��
Al(OH)3+OH-=AlO2-+2H2O
n(Al3+) 0.007mol
����n(Al3+)=0.007mol���������ӳ�����Ҫ��������0.021mol��������Һ��H+������������0.014mol�������ӵ����ʵ�����0.014mol��
NH4++OH-=NH3H2O��������������0.007mol������笠����ӵ����ʵ�����0.007mol��ԭ��Һ��c(NH4+)��c(Al3+)�ı�ֵΪ1��1��
����Al(OH)3������Ϊ0.007mol��78g/mol=0.546g��
(4)��Һ�д��ڵ�����Ϊ��Na+��Al3+��NH4+��H+��SO42-����֪���ᱵ����Ϊ2.33g����n(SO42-)=![]() =0.01mol������n(Al3+)=0.007mol��n(H+)=0.014mol��n(NH4+)=0.007mol����Һ�д��ڵ���غ㣬3n(Al3+)+n(H+)+n(NH4+)+n(Na+)=3��0.007mol+0.014mol+0.007mol+0.14 mol��L-1��0.1L=0.056mol��2n(SO42-)=0.02mol����һ������NO3-����n(NO3-)=0.056mol-0.02mol=0.036mol��c(NO3-)=
=0.01mol������n(Al3+)=0.007mol��n(H+)=0.014mol��n(NH4+)=0.007mol����Һ�д��ڵ���غ㣬3n(Al3+)+n(H+)+n(NH4+)+n(Na+)=3��0.007mol+0.014mol+0.007mol+0.14 mol��L-1��0.1L=0.056mol��2n(SO42-)=0.02mol����һ������NO3-����n(NO3-)=0.056mol-0.02mol=0.036mol��c(NO3-)=![]() =0.36mol/L��
=0.36mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ��NaX��NaY��NaZ��Һ����pH����Ϊ8��9��10����HX��HY��HZ��������ǿ������˳����( )
A.HX��HZ��HYB.HX��HY��HZC.HZ��HY��HXD.HY��HZ��HX
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڵ���ʵ���
A. �������� B. ����ͭ C. �Ȼ�����Һ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PC15����ӦPCl5(g)![]() PCl3(g)+Cl2(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
PCl3(g)+Cl2(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
����˵������ȷ����
A. ��Ӧ��ǰ 50 s ��ƽ������v(PCl3)=0.0016 mol L-1 s-1
B. ���������������䣬�����¶ȣ�ƽ��ʱc(PCl3)=0.11 mol L-1����Ӧ����H��0
C. ��ͬ�¶��£���ʼʱ�������г���1.0 mol PC15��0.20 mol PC13��0.20 molCl2����Ӧ�ﵽƽ��ǰv(��)>v(��)
D. ��ͬ�¶��£���ʼʱ�������г���2.0mol PC13��2.0mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ֻ�漰�����仯����
A. ��н��̿ B. ��Ƴɴ� C. ��ˮ�ɱ� D. �����ɸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϩ�����ڼ����������ܿ��پۺ�Ϊ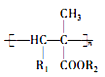 ���Ӷ����н���ԣ�ij�������ϩ����(H)�ĺϳ�·�����£�
���Ӷ����н���ԣ�ij�������ϩ����(H)�ĺϳ�·�����£�
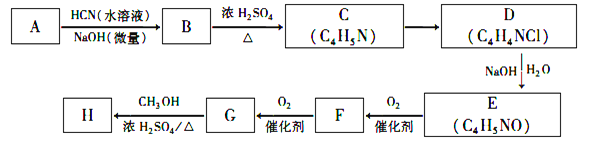
��֪����A����Է�����Ϊ58����Ԫ����������Ϊ0. 276���˴Ź���������ʾΪ���壻

�ش��������⣺
��1��A�Ļ�ѧ����Ϊ____________��
��2��G�Ľṹ��ʽΪ________________��G�еĺ�����������________________��������������ƣ�
��3����B����C�ķ�Ӧ����Ϊ_______________����C����D�ķ�Ӧ����Ϊ_____________��
��4����E����F�Ļ�ѧ����ʽΪ________________________________��
��5��H��ͬ���칹���У������������ܷ���������Ӧ���˴Ź�������֮����1��1��3��ͬ���칹��ṹ��ʽ_____________________________________________����д���ּ��ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����O2��ȼ��0.22g����Ԫ�غ���Ԫ����ɵĻ����ʹ���е���Ԫ��ȫ��ת��ΪSO2������ЩSO2ȫ��ת��ΪSO3�����ɵ� SO3��ȫ�� H2O ���ա����� H2SO4���� 10.0 mL 0.50 mol��L-1�� NaOH��ȫ�кͣ���ԭ����������Ԫ�ص���������ԼΪ
A. 45% B. 36% C. 20% D. 40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�֮����Ũ������������ȥһ����ˮ������Σ���ͼ��ʾ��
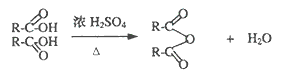
ij�������A�ǹ㷺ʹ�õ��������ܼ���A�������������ܹ�����B��C��D,ת����������ͼ��ʾ����ش����������⣺
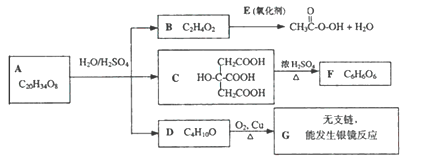
(1)CH3COOOH��Ϊ�������ᣬд������һ����;____________��
(2)д��B+E��CH3COOOH+H2O�Ļ�ѧ����ʽ________________________��
(3)�ɸ�����Ϣд��F���ܵĽṹ��ʽ____________��
(4)д��A�Ľṹ��ʽ____________
(5)1Ħ��C�ֱ�������Ľ���Na��NaOH��Ӧ������Na��NaOH���ʵ���֮����____________��
(6)д��D�������ᣨ���廯�ƺ�Ũ����Ļ������ȷ�Ӧ�Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ȼ����ɿɱ�ʾΪxNa2CO3��yNaHCO3��zH2O��ȡm g����Ȼ�����1L��ҺM��ȡ��100mLM�����м���50mL1 mol��L��1���ᣬ����ǡ����ȫ��Ӧ����NaCl,ͬʱ����CO2�����Ϊ672mL����״���£��������ƶ���ȷ������ ��
A. m g����Ȼ���к�0.3molNa2CO3 B. m g����Ȼ���к�0.3molNa+
C. ��ҺM��c��Na+��=0.5 mol��L��1 D. ����Ȼ����x:y:z=2:1:2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com