
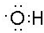 ;
; ;
;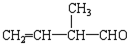 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
. 分析 (1)羟基为中性原子团,氧原子最外层含有7个电子;
(2)该有机物为烷烃,根据烷烃的命名原则写出其名称;
(3)首先写出结构式,根据结构式再写出键线式;碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略.
(4)根据官能团结构确定官能团的名称;含有不饱和键的化合物单体间相互加成形成新的共价键相连大分子的反应.
解答 解:(1)羟基中含有1个O-H键,为中性原子团,羟基的电子式为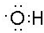 ,
,
故答案为: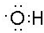 ;
;
(2)(CH3CH2)2C(CH3)2中最长碳链含有5个C,在3号C含有2个甲基,其名称为:3,3-二甲基戊烷,
故答案为:3,3-二甲基戊烷;
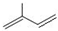
(3)(3)2-甲基-1,3-丁二烯的结构简式为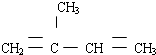 所以键线式为
所以键线式为 .
.
故答案为:
(4)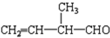 含官能团的名称是碳碳双键,醛基;
含官能团的名称是碳碳双键,醛基;
发生加聚反应为:n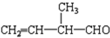 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ ,则所得产物的结构简式为
,则所得产物的结构简式为 ,
,
故答案为:碳碳双键,醛基; .
.
点评 本题考查化学用语、有机物的命名等,题目难度中等,结构决定性质,熟记常见官能团及性质,明确常见化学用语的书写原则为解答关键,试题培养了学生的灵活应用能力.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③④⑤ | B. | 仅②③④ | C. | 仅①③④ | D. | 仅①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
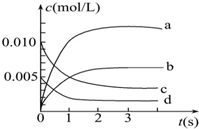 在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数等于或大于3的元素一定是主族元素 | |
| B. | 原子最外层只有1个电子的元素一定是第IA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定位于第二周期 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在卤代烃中,卤素原子与碳原子间形成共价键 | |
| B. | 在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 | |
| C. | 聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 | |
| D. | 卤代烃的沸点比相应烷烃的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH=CHCH2CH3不存在顺反异构体 | |
| B. | 分子式为C5H10O2的羧酸有8种 | |
| C. |  的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 | |
| D. | 棱晶烷  为正三棱柱形,它的二氯代物有5种 为正三棱柱形,它的二氯代物有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com