
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道或两个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s轨道以“头碰头”方式重叠构建而成的是( )
A.H2 B.HClC.Cl2 D.F2
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.“海沙危楼”是由于海沙带有腐蚀性,会腐蚀混凝土中的钢筋等
B.食用地沟油对人体危害极大,是因为含有黄曲霉素等有毒物质
C.开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D.光化学烟雾、温室效应、硝酸型酸雨的形成都只与氮氧化物有关
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
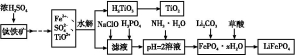
已知:H2TiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是 。
(2)TiO2+水解生成H2TiO3的离子方程式为 。
(3)加入NaClO发生反应的离子方程式为 。
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 (填“偏高”、“偏低”或“无影响”),滴定终点的现象是 。滴定分析时,称取a g钛铁矿,处理后,用c mol/L KMnO4标准液滴定,消耗V mL,则铁元素的质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O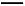 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
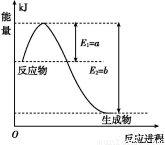
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度
C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题:黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:3FeS2+8O2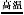 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
图表法、图像法是常用的科学研究方法。
Ⅰ.图(A)是短周期某主族元素X的电离能所示情况。则X元素位于周期表的第 族。
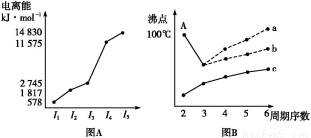
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
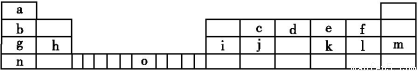
试回答下列问题:
(1)请写出元素o的外围电子排布式: 。
(2)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是
(填化学式),试从结构角度加以解释:
(3)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
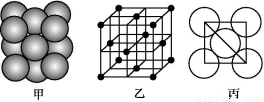
请回答:晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
下列说法不正确的是( )
A.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺都符合绿色化学的思想
B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C.石油裂解、煤的气化、橡胶老化、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中只形成气溶胶
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
在接触法产生H2SO4的过程中,对“废气、废水、废渣、废热”的处理正确的是( )
①废气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥或炼铁 ④设置“废热”锅炉产生蒸气来供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:填空题
一定温度下2 L的恒容容器甲中,加入2 mol碳和2 mol CO2发生如下反应: C(s)+CO2(g)  2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
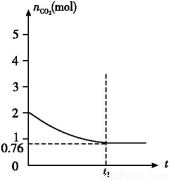
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数 (结果保留一位小数)。
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填“增大”、“减小”、“不变”或“无法确定”)。
(4)相同温度下,2 L的恒容容器乙中加入4 mol碳和4 mol CO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(5)相同温度下,2 L的恒容容器丙中加入4 mol碳、4 mol CO2和4 mol CO。开始反应时v正 v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:选择题
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
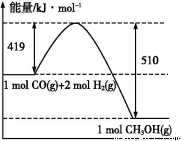
C.上图是298 K、101 Pa时CO和H2合成CH3OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH=+91 kJ·mol-1
CH3OH(g) ΔH=+91 kJ·mol-1
D.已知:2Zn(s)+O2(g) 2ZnO(s) ΔH=-701.0 kJ/mol
2ZnO(s) ΔH=-701.0 kJ/mol
2Hg(l)+O2(g) 2HgO(s) ΔH=-181.6 kJ/mol
2HgO(s) ΔH=-181.6 kJ/mol
则Zn(s)+HgO(s) ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1
ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com