
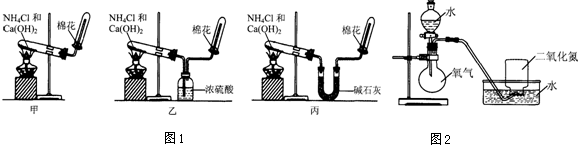
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
分析 (1)依据图一装置可知三位同学制取氯气方法都是用加热固体 氯化铵和氢氧化钙的方法;
(2)浓硫酸为碱性气体,不能干燥氨气;
(3)氨气为碱性气体,能够使石蕊的红色石蕊试纸变蓝,氨气能够与氯化氢反应生成白色固体氯化铵,产生大量白烟,据此检验氨气存在;
(4)碳酸氢铵受热分解生成氨气、二氧化碳和水,制取纯净氨气应除去二氧化碳和水蒸气;
(5)二氧化氮溶于水,发生3NO2+H2O=2HNO3+NO,通入氧气发生2NO+O2=2NO2,重复操作②,总反应为4NO2+O2+2H2O=4HNO3,据此解答.
解答 解:(1)三位同学制取氯气方法都是用氯化铵和氢氧化钙加热生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)浓硫酸为碱性气体,能够与氨气反应吸收氨气,不能干燥氨气,所以乙同学不能收集到氨气;
故答案为:乙;
(3)氨气为碱性气体,能够使石蕊的红色石蕊试纸变蓝,氨气能够与氯化氢反应生成白色固体氯化铵,产生大量白烟,所以为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒)置于收集气体的试管口处,若观察到试纸变蓝(或白烟产生),则说明氨气已收集满;
故答案为;湿润的红色石蕊试纸(或用蘸有浓盐酸的玻璃棒);试纸变蓝(或白烟产生);
(4)碳酸氢铵受热分解生成氨气、二氧化碳和水,制取纯净氨气应除去二氧化碳和水蒸气,甲同学没有除去二氧化碳,乙同学用浓硫酸干燥氨气,能够吸收氨气,丙同学用碱石灰可以吸收氨气中的水蒸气和二氧化碳,能够制取氨气;
故选:丙;
(5)①依据方程式:3NO2+H2O=2HNO3+NO,可知3体积二氧化氮与水反应生成1体积一氧化氮,一氧化氮难溶于水,所以最终剩余气体约占集气瓶体积的三分之一;
②将水逐滴滴入烧瓶,向盛有NO2的集气瓶通入少量氧气后,停止通气,先后发生反应:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,所以看到的现象为:先由无色变为红棕色,再变成无色;
③多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,最终二氧化氮全部被吸收生成硝酸,所以气体不再变成红棕色;
依据4NO2+O2+2H2O=4HNO3,可知二氧化氮都能转化为硝酸,448mLNO2全部溶于水,得到500mL溶液,则硝酸的物质的量=$\frac{0.448L}{22.4L/mol}$=0.02mol;
硝酸的物质的量浓度C=$\frac{0.02mol}{0.5L}$=0.04mol/L;
故答案为:
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的 三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是 先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成 红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为 0.04mol/L. | |
点评 本题以氨气、硝酸的制备为载体,考查了氨气制备方法、硝酸的制备方法,明确制备原理及氨气、一氧化氮、二氧化氮的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )| A. | X原子可能为第VA族元素 | |
| B. | 该分子中既含有极性共价键又含有非极性共价键 | |
| C. | Y 原子可能为第ⅠA 族或第ⅦA 族元素元素 | |
| D. | 从圆球的大小分析,该分子可能为 N2F4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
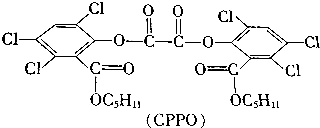
| A. | 32种 | B. | 36种 | C. | 64种 | D. | 72种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
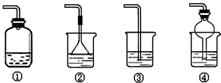
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
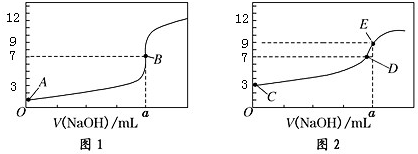
| A. | 图 1 是滴定 CH3COOH 溶液的曲线 | |
| B. | 图 2 若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点 D 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果 C、E 两点对应的 pH 分别为 3、9,则水电离的氢离子浓度之比为 1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
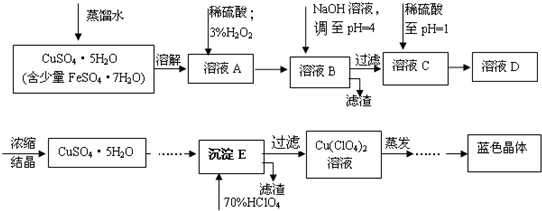
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
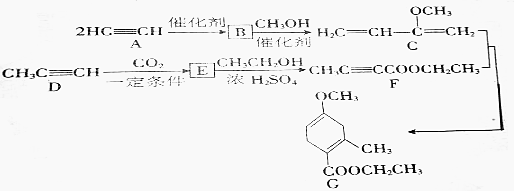
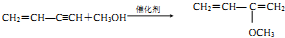 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com