
分析 (1)根据热化学方程式的意义计算出1克物质完全燃烧后放出的热量,然后比较大小;
(2)根据热化学方程式的意义得1mol物质完全燃烧后放出的热量,然后比较大小;
解答 解:(1)由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1可知1克CH4完全燃烧后放出的热量为$\frac{890kJ}{16}$=55.625kJ,
由H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1可知1克H2完全燃烧后放出的热量为$\frac{285.8kJ}{2}$=142.9kJ,
由C(s)+O2(g)=CO2(g)△H=-393.6kJ•mol-1可知1克C完全燃烧后放出的热量为=$\frac{393.6kJ}{12}$=32.8kJ,
所以完全燃烧等质量的CH4,H2,C,放出热量由少到多的次序为H2>CH4>C;
故答案为:H2>CH4>C;
(2)由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1可知1molCH4完全燃烧后放出的热量为890kJ;
由H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1可知1molH2完全燃烧后放出的热量为285.8kJ;
由C(s)+O2(g)=CO2(g)△H=-393.6kJ•mol-1可知1molC完全燃烧后放出的热量为393.6kJ;
所以完全燃烧等物质的量的CH4,H2,C,放出热量由少到多的次序为CH4>C>H2;
故答案为:CH4>C>H2;
点评 本题主要考查了反应中热效应的计算,掌握热化学方程式的意义是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;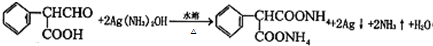 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
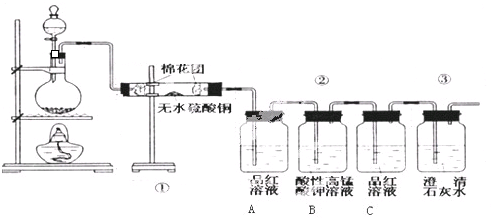
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
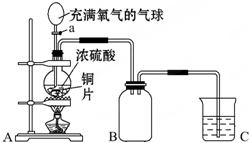 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此装置可以实现Cl2的制取、收集、尾气吸收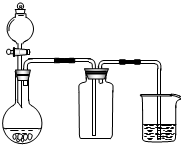 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3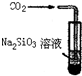 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com