
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___,基态D原子价电子的轨道表达式为___,DA2分子的VSEPR模型是___。
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
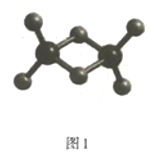
①C2Cl6属于___晶体(填晶体类型),其中C原子的杂化轨道类型为___杂化。
②[C(OH)4]-中存在的化学键有___。
③C2Cl6与过量的NaOH溶液反应的化学方程式为___。
(3)B、C的氟化物晶格能分别是2957kJmol-1、5492kJmol-1,二者相差很大的原因是___。
(4)D与E所形成化合物晶体的晶胞如图2所示。
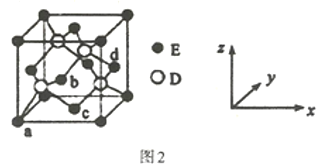
①在该晶胞中,E的配位数为___。
②已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为___pm(列出计算式即可)。
【答案】镁(或Mg) ![]() 平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) Al2Cl6+2NaOH+6H2O=2Na[Al(OH)4]+6HCl Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgF2大得多 4
平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) Al2Cl6+2NaOH+6H2O=2Na[Al(OH)4]+6HCl Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgF2大得多 4 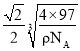 ×1010
×1010
【解析】
由A、D同主族且有两种常见化合物![]() 和
和![]() ,可推出A为O,D为S;由工业上电解熔融
,可推出A为O,D为S;由工业上电解熔融![]() 制取单质C,可推出C为Al;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区,且A、B、C、D、E五种元素原子序数依次增大,可推出B为Mg,E为Zn。
制取单质C,可推出C为Al;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区,且A、B、C、D、E五种元素原子序数依次增大,可推出B为Mg,E为Zn。
(1)根据上述分析,B为Mg元素,C为Al元素,镁的最外层s轨道上有2个电子,处于全充满状态,比相邻元素的第一电离能大,则Mg、Al中第一电离能较大的是Mg;D为S元素,基态原子核外电子排布式为![]() ,则基态D原子价电子的轨道表达式为
,则基态D原子价电子的轨道表达式为![]() ;
;
![]() 为
为![]() ,根据价层电子对互斥理论可知,
,根据价层电子对互斥理论可知,![]() 中硫原子含有的孤电子对数是
中硫原子含有的孤电子对数是![]() ,成键电子对数为2,采用
,成键电子对数为2,采用![]() 杂化,则
杂化,则![]() 分子的VSEPR模型是平面三角形;
分子的VSEPR模型是平面三角形;
(2)![]() 是
是![]() ,根据题意,
,根据题意,![]() 在加热时易升华,说明该分子的熔沸点较低,则
在加热时易升华,说明该分子的熔沸点较低,则![]() 属于分子晶体;根据图给球棍模型可知,Al原子形成4个共价单键,则Al原子的杂化轨道类型为
属于分子晶体;根据图给球棍模型可知,Al原子形成4个共价单键,则Al原子的杂化轨道类型为![]() 杂化;
杂化;
![]() 中Al最外层有3个电子,与O原子形成三个极性共价键,Al原子还有一个空轨道,与氧原子的孤对电子形成配位键,所以
中Al最外层有3个电子,与O原子形成三个极性共价键,Al原子还有一个空轨道,与氧原子的孤对电子形成配位键,所以![]() 中存在的化学键有极性共价键和配位键;
中存在的化学键有极性共价键和配位键;
![]() 与过量的NaOH溶液反应生成偏铝酸钠,化学方程式为
与过量的NaOH溶液反应生成偏铝酸钠,化学方程式为![]() ;
;
(3)B、C的氟化物分别为![]() 、
、![]() ,因为
,因为![]() 比
比![]() 电荷高、半径小,所以
电荷高、半径小,所以![]() 的晶格能比
的晶格能比![]() 大得多。
大得多。
(4)![]() 根据如图所示晶胞,E原子位于顶点和面心,面心上的E原子,与它等距离最近的D原子有4个,则在该晶胞中,E的配位数为4。
根据如图所示晶胞,E原子位于顶点和面心,面心上的E原子,与它等距离最近的D原子有4个,则在该晶胞中,E的配位数为4。
![]() 根据如图所示晶胞,晶胞中有E原子
根据如图所示晶胞,晶胞中有E原子![]() ,D原子位于四分之一晶胞中的4个小正方体的体心上,一共有4个,设该晶胞的边长为xcm,已知该晶胞的密度为
,D原子位于四分之一晶胞中的4个小正方体的体心上,一共有4个,设该晶胞的边长为xcm,已知该晶胞的密度为![]() ,则晶胞的边长
,则晶胞的边长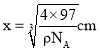 ,其观察晶胞图可知:4个Zn原子分布于8个
,其观察晶胞图可知:4个Zn原子分布于8个![]() 晶胞的中心,并且这4个Zn原子呈正四面体结构,所以2个Zn原子的距离为面对角线的一半,即为
晶胞的中心,并且这4个Zn原子呈正四面体结构,所以2个Zn原子的距离为面对角线的一半,即为 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是( )
A.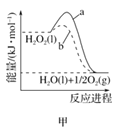 图甲表示H2O2在有、无催化剂下的分解反应能量变化曲线,b表示有催化剂时的反应
图甲表示H2O2在有、无催化剂下的分解反应能量变化曲线,b表示有催化剂时的反应
B. 图乙表示0.1molMgCl26H2O在空气中充分加热时固体质量随时间的变化
图乙表示0.1molMgCl26H2O在空气中充分加热时固体质量随时间的变化
C.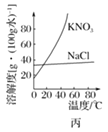 图丙表示KNO3和NaCl的溶解度曲线,若欲除去NaCl中少量KNO3,可将混合物制成较高温度下的浓溶液再冷却结晶、过滤
图丙表示KNO3和NaCl的溶解度曲线,若欲除去NaCl中少量KNO3,可将混合物制成较高温度下的浓溶液再冷却结晶、过滤
D.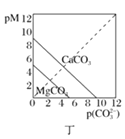 图丁表示碳酸盐的溶解平衡曲线[pM=-lgc(M),p(CO32-)=-lgc(CO32-)],则Ksp(CaCO3)>Ksp(MgCO3)
图丁表示碳酸盐的溶解平衡曲线[pM=-lgc(M),p(CO32-)=-lgc(CO32-)],则Ksp(CaCO3)>Ksp(MgCO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,该电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时正极附近溶液的碱性减弱
B.充电时阳极反应为:Fe(OH)3-3eˉ+5OHˉ=FeO42ˉ+4H2O
C.放电时每转移 3 mol 电子,正极有 1 mol K2FeO4 被还原
D.放电时负极反应为:Zn-2eˉ+2OHˉ=Zn(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。下列说法错误的是( )
A.蚕丝属于天然高分子材料
B.雾霾纪录片《穹顶之下》,提醒人们必须十分重视环境问题,提倡资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle)
C.化石燃料完全燃烧不会造成大气污染
D.中国古代用明矾溶液清洗铜镜表面的铜锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种可充电锂电池,反应原理是4Li+FeS2![]() Fe+2Li2S,LiPF6是电解质,SO(CH3)2是溶剂。下列说法正确的是( )
Fe+2Li2S,LiPF6是电解质,SO(CH3)2是溶剂。下列说法正确的是( )
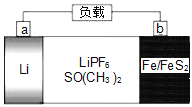
A.放电时,电子由a极经电解液流向b极
B.放电时,电解质溶液中PF6-向b极区迁移
C.充电时,b极反应式为Fe+2Li2S-4e-=FeS2+4Li+
D.充电时,b极消耗5.6gFe时在a极生成0.7gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行下列实验时,温度计水银球置于反应物液面以下的是 ( )
A.乙醇和浓硫酸混合加热到170°C制乙烯B.从石油中提炼汽油
C.用蒸馏方法提纯水D.实验室制取硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水(主要以H3AsO3形式存在)提取As2O3的工艺流程如下:
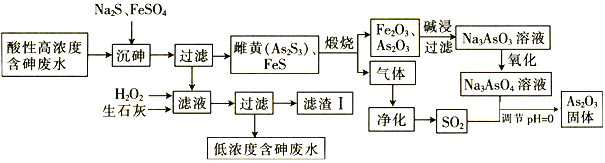
回答下列问题:
(1)上述流程的_____过程中由于条件的原因,造成生成物中混有Fe3O4,为证明Fe3O4的存在,可利用Fe3O4具有_______性的这一物理性质。
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为________。
(3)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:

①H3AsO3为_______元_______(填“强”或“弱”)酸。
②pH由7调节至10的过程中发生反应的离子方程式为__________。
③H3AsO3的一级电离平衡常数Ka1=__________。
(4)滤渣Ⅰ中含有FeAsO4、Fe(OH)3、Ca3(AsO4)2和 _______(填化学式);已知Ksp[FeAsO4]=5.7×10-21 ,含砷污染物允许排放标准为不大于0.5 mgL-1。若低浓度含砷废水(假设砷均以Na3AsO4形式存在)中Fe3+的浓度为1. 0×10-4 molL-1 ,则低浓度含砷废水中Na3AsO4的浓度为_____ mgL-1,_____(填“符合”或“不符合”)排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石中的碳化钙和水能完全反应:CaC2+2H2O=C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积,可计算出标准状况下乙炔的体积,从而可测定电石中碳化钙的含量。
(1)若用下列仪器和导管组装实验装置

如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:____接____接____接____接____接____。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不产生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是__________________。
(3)若实验产生的气体有难闻气味,且测定结果偏大,这是因为电石中含有___________杂质。
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com