
| A. | 1mol•L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目为3NA | |
| B. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| C. | 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA | |
| D. | 标准状况下,2.24 LCl2溶于水,转移电子的数目为0.1NA |
分析 A、铁离子是弱碱阳离子,在溶液中会水解;
B、铁和足量的稀硝酸反应后变为+3价;
C、Cu2S的摩尔足量是CuO的2倍,含有的铜原子也是CuO的2倍;
D、氯气和水的反应是可逆反应.
解答 解:A、铁离子是弱碱阳离子,在溶液中会水解,故当铁离子为NA个时,溶液中的氯离子的个数大于3NA个,故A错误;
B、铁和足量的稀硝酸反应后变为+3价,故1mol铁和硝酸反应后转移3NA个电子,故B错误;
C、Cu2S的摩尔质量是CuO的2倍,含有的铜原子也是CuO的2倍,故8.0g混合物可以认为均由CuO构成,故含有的CuO的物质的量为n=$\frac{8g}{80g/mol}$=0.1mol,则含0.1NA个铜原子,故C正确;
D、氯气和水的反应是可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
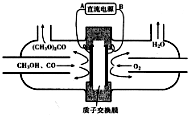
| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
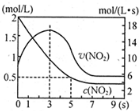 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: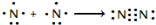 .
.| 化学键 | N-H | N-N | N=N | N≡N | O=O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③⑤⑥② | B. | ①⑤③④⑥② | C. | ①③④⑥⑤② | D. | ①③⑤⑥④② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
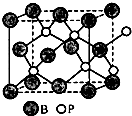 X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.
X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.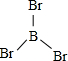 .
.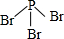 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
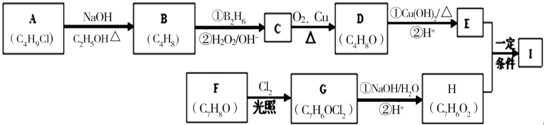
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用固体氢氧化钠配制标准溶液时其中混有Na2O杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现碱式滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子数目为1.5NA个 | |
| B. | 1 molNa2O2与足量CO2反应,转移的电子数为2NA个 | |
| C. | 1L,1mol/L CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA个 | |
| D. | 6.0g SiO2晶体中含有0.1NA个SiO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com