
【题目】I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:
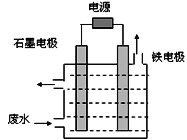
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
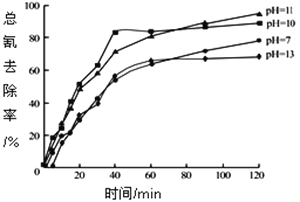
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解释该pH不宜太大的原因___________________。
.11~13),解释该pH不宜太大的原因___________________。
【答案】 吸热 1.60 CE 阴极 Cl-+2OH--2e-=ClO-+H2O 2CN-+5ClO-+2OH-=N2↑+5Cl-+2CO32-+H2O ![]() b pH太大溶液中发生[4Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O,生成更稳定[Fe(CN)6]4-难以除去
b pH太大溶液中发生[4Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O,生成更稳定[Fe(CN)6]4-难以除去
【解析】试题分析:本题考查外界条件对化学平衡和化学平衡常数的影响,化学平衡常数的计算,电解原理和电极反应式的书写,图像的分析。
I.(1)反应①升高温度,K1增大,升高温度平衡向正反应方向移动,正反应为吸热反应,反应①是吸热反应。
(2)根据化学平衡常数的概念写出平衡常数表达式,K1=c(CO)/c(CO2),K2=c(H2)/c(H2O),K3=![]() =K2/K1,973K时K3=
=K2/K1,973K时K3=![]() =1.60。
=1.60。
(3)A,缩小反应容器的容积,增大压强,反应③的平衡不移动;B,扩大反应容器的容积,减小压强,反应③的平衡不移动;C,1173K时K3=![]() =0.78
=0.78![]() 1.60,升高温度反应③的K3减小,平衡向逆反应方向移动;D,使用合适的催化剂,能加快反应速率缩短达到平衡的时间,不能使化学平衡发生移动;E,设法减小平衡体系中CO浓度,平衡向逆反应方向移动;能使反应③的平衡向逆反应方向移动的措施有C、E,答案选CE。
1.60,升高温度反应③的K3减小,平衡向逆反应方向移动;D,使用合适的催化剂,能加快反应速率缩短达到平衡的时间,不能使化学平衡发生移动;E,设法减小平衡体系中CO浓度,平衡向逆反应方向移动;能使反应③的平衡向逆反应方向移动的措施有C、E,答案选CE。
II.(1)一定条件下电解加入NaCl的含CN-废水时阳极产生ClO-,则阳极为惰性电极,石墨电极为阳极,铁电极为阴极。阳极Cl-失去电子被氧化成ClO-,阳极电极反应为Cl--2e-+2OH-=ClO-+H2O。ClO-将CN-氧化为无害物质,在碱性溶液中CN-被氧化成CO32-和N2,ClO-被还原成Cl-,反应的离子方程式为5ClO-+2CN-+2OH-=5Cl-+2CO32-+N2↑+H2O。
(2)①HCN的电子式为![]() 。
。
②根据图像,pH=7和pH=13总氰去除率低;pH=10和pH=11总氰去除率高;pH选择的最佳范围应为10~11,答案选b。根据资料,[Fe(CN)6]3-转化为CN-容易被H2O2除去,pH太大溶液中发生反应:[Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O,生成更稳定[Fe(CN)6]4-难以转化为CN-而除去。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A.Ca(OH)2=Ca2++2(OH)-B.FeCl2=Fe2++3Cl-
C.H2SO4=H2++SO42-D.Al2(SO4)3=2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为___________, 其中氮的化合价为___________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为____________.
(3)①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4=______________, 联氨和N2O4可作为火箭推进剂的主要原因为______________________.
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为_____ (已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为_______________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_______________. 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2__________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的反应原理,不正确的是
A. 铝热法炼铁:Fe2O3 + 2Al 高温Al2O3 + 2Fe
B. 火法炼铜:Cu2S + O2 高温2Cu + SO2
C. 电解法制钠:2NaCl(熔融) 电解2Na + Cl2↑
D. 电解法制镁:2MgO(熔融) 电解2Mg + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法有错误的是
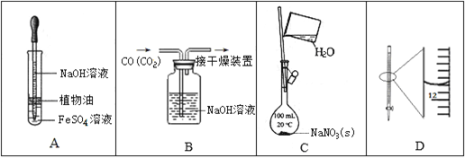
A. 观察Fe(OH)2的生成
B. 除去CO中的CO2
C. 配制一定物质的量浓度的NaNO3溶液
D. 25 mL滴定管读数为11.80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
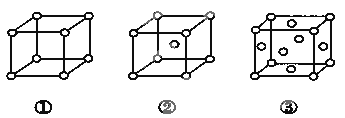
A. ①、②、③依次为简单立方堆积、六方最密堆积、体心立方堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③6个
C. 晶胞中原子的配位数分别为:①6, ②8 ,③12
D. 空间利用率的大小关系为:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:
①![]() ;ΔH=
;ΔH=![]() 196.6kJmol-1
196.6kJmol-1
②![]() ;ΔH<0
;ΔH<0
③![]() ;ΔH=
;ΔH=![]() 92.4 kJmol-1
92.4 kJmol-1
(1)在一定条件下向一密闭容器中充入1mol SO2和0.5mol O2,充分反应后,放出的热量_________(填“<”“>”“=”)98.3kJ;理由是_____________________;
(2)反应②的化学平衡常数表达式K=___________,温度降低时,K值_______(填“增大”、“减小”或“无影响”);
(3)在0.2L的密闭容器中,加入1.0mol N2 和 3.0mol H2当该反应达到平衡时,测出平衡混合气的总物质的量为3 mol,则平衡时氮气的转化率=___________;
(4)反应③中为有效提高氢气的转化率,理论上可采取的措施有____________________。
A.升高温度 B.增大压强 C.减小压强 D.及时移出氨 E.循环利用和不断补充氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com