
| A. | 微粒半径:Cl>S>N>O | B. | 稳定性:HF>HCl>HBr>HI | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3 |
分析 A.电子层越多,原子半径越大;同周期原子序数大的原子半径小;
B.非金属性越强,氢化物越稳定;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.金属性越强,对应最高价氧化物的水化物碱性越强.
解答 解:A.同一周期元素,随着核电荷数的增加,原子半径减小,故S原子半径大于Cl原子半径,故A错误;
B.非金属性越强,氢化物越稳定,则稳定性:HF>HCl>HBr>HI,故B正确;
C.非金属性越强,对应最高价氧化物的水化物酸性越强,则酸性为HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D.金属性越强,对应最高价氧化物的水化物碱性越强,则碱性为KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故D正确;
故选A.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 乙醛能发生氧化反应但不能发生还原反应 | |
| B. | 苯酚能与溴水发生取代反应 | |
| C. | 酯化反应是可逆反应 | |
| D. | 乙醇和乙醚互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将甲、乙作电极组成原电池时,甲是负极 | |
| B. | 同价态的阳离子,甲比乙的氧化性强 | |
| C. | 甲与稀盐酸反应放出氢气的体积比乙与稀盐酸反应放出氢气的体积大 | |
| D. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沼气是一种清洁的能源 | |
| B. | 使用沼气做能源是解决农村能源的主要途径 | |
| C. | 使用沼气给农民的生活带来了不便 | |
| D. | 使用沼气是对化学能的充分利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
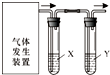 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| B | 检验CH3CH2Br消去反应后的气体产物 | 水 | KMnO4溶液 |
| C | 检验FeSO4受热分解产生的气体中有SO3和SO2 | BaCl2溶液 | 品红溶液 |
| D | 验证醋酸、碳酸、硅酸酸性强弱 | NaOH溶液 | Na2SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com