
【题目】对于符号:35Cl和37Cl、H2和D2、1H216O和2H218O。下列有关说法正确的是( )
A. 35Cl和37Cl互称为同素异形体B. H2和D2是氢元素的两种同位素
C. 35和37表示的是质量数D. 1H216O和2H218O表示同一种水分子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】细胞中常见的化学元素有20多种,其中有些含量较多,称为大量元素;有些含量很少,称为微量元素。下列各组元素中,全是微量元素的是( )
A. Fe、Mn、B、Mo、S B. H、O、Ca、Mg
C. P、N、K、Ca、Mg D. Mo、Zn、Cu、B、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1 mol·L-1NH4Cl溶液加水稀释,![]() 的值减小
的值减小
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式 K= , △H0(填“>”、“<”或“=”).
(2)在一个容积为10L的密闭容器中,1300℃时加入 Fe、Fe2O3、CO、CO2各1mol,反应经过10min 后达到平衡.求该时间范围内反应的平均反应速率 v(CO2)= , CO 的平衡转化率为 .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.增加Fe2O3的量
B.加入合适的催化剂
C.移出部分CO2
D.提高反应温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:
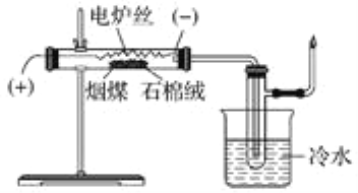
(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用新技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。
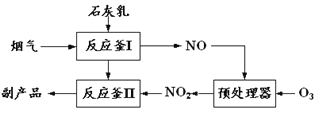
①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是_____。
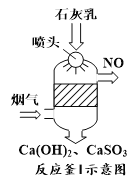
②反应釜II中CaSO3转化为CaSO4的化学反应方程式为_____。
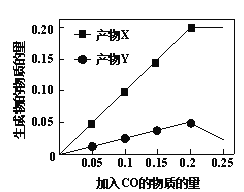
(2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是____。
(3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是_____。
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是______。
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:_____。
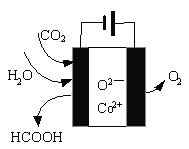
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案的设计与评价合理的是 (_____)
A | B | C | D |
|
|
|
Ⅰ为Al电极,其他均为Cu电极 |
| 验证氧化性:Cl2>Br2>I2 | 验证温度对平衡移动的影响 | 电子流动方向:电极Ⅳ→A→电极Ⅰ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
A.摩尔是国际单位制七个基本物理量之一
B.1 L 0.1 mol/L BaCl2溶液中所含的Cl﹣为0.1 NA
C.常温常压下,11.2 L Cl2所含的分子数为0.5 NA
D.常温常压下,32 g O2含有的氧原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O ![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1molCO2和3mol H2 , 一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 测得CO2和CH3OH(g)的浓度随时间变化如图所示. ①从3min到9min,v(H2)=molL﹣1min﹣1
②能说明上述反应达到平衡状态的是(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2 , 同时生成1mol HO
D.CO2的体积分数在混合气体中保持不变.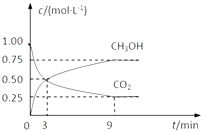
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com