
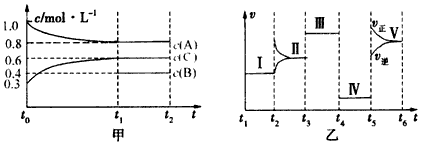
分析 由图可知,t0~t1阶段A减少0.2mol/L、C增加0.6mol/L-0.3mol/L=0.3mol/L,结合v=$\frac{△c}{△t}$计算速率,A、C的化学计量数之比为2:3,结合图乙中t4~t5时降低压强平衡不移动可知,反应为2A(g)+B(g)?3C(g),t5时正逆反应速率均增大,且正反应速率大于逆反应速率,可知改变条件为升高温度,正反应为吸热反应,以此来解答.
解答 解:(1)t1=15s,则t0~t1阶段的反应速率为v(C)=$\frac{0.6mol/L-0.3mol/L}{15s}$=0.02mol/(L•s),故答案为:0.02mol/(L•s);
(2)t3时刻为使用催化剂,t4~t5时正逆反应速率同等程度的减小,则改变条件为减小压强,故答案为:减小压强;
(3)t0~t1阶段A减少0.2mol/L、C增加0.6mol/L-0.3mol/L=0.3mol/L,A、C的化学计量数之比为2:3,结合图乙中t4~t5时降低压强平衡不移动可知,反应为2A(g)+B(g)?3C(g),t5时正逆反应速率均增大,且正反应速率大于逆反应速率,可知改变条件为升高温度,正反应为吸热反应,t0~t1阶段该反应吸收的热量为Q kJ,0.2mol/L×4L=0.8molA参加反应吸收QkJ,则2molA参加反应吸收热量为2.5QkJ,即该反应的热化学方程式为2A(g)+B(g)?3C(g)△H=+2.5 Q kJ/mol,故答案为:2A(g)+B(g)?3C(g)△H=+2.5 Q kJ/mol.
点评 本题考查化学平衡计算,为高频考点,把握图中浓度的变化、图象分析为解答的关键,侧重分析与应用能力的考查,注意(3)为解答的难点,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba( NO3-)2=Ba2++( NO3-) 2 | B. | NaHSO4=Na++H++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | KClO3=K++ClO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 加压可使速率加快,是因为增加活化分子百分数而使反应速率加快 | |
| C. | 活化分子的碰撞不一定都能发生化学反应 | |
| D. | 催化剂可改变反应进程,故加催化剂改变了一个反应的△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com