
 蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.
蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.分析 (1)非金属性越强,电负性越大;S元素处于第三周期VIA族;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同; CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4;与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1;
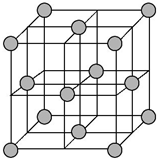
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$×127.8pm,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)非金属性越强,电负性越大,故电负性:N<O;S元素处于第三周期VIA族,基态硫原子的价电子排布式为3s23p4,
故答案为:N<O;3s23p4;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同,故为CO2或N2O等; CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键,1mol CN-中含有的π键的数目为2×6.02×1023,
故答案为:CO2或N2O等;2×6.02×1023;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4,N原子轨道的杂化类型是sp3,
与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1,分别为K、Cr,
故答案为:sp3;K、Cr;
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$×127.8pm,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{64}{{N}_{A}}$g,则晶胞密度4×$\frac{64}{{N}_{A}}$g÷($\sqrt{2}$×127.8×10-10 cm)3=$\frac{4×64}{{N}_{A}(2\sqrt{2}×127.8×1{0}^{-10})^{3}}$g•cm-3,
故答案为:$\frac{4×64}{{N}_{A}(2\sqrt{2}×127.8×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、等电子体、化学键杂化方式、晶胞计算等,(4)中关键是明确原子半径与晶胞边长关系,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化钠溶液中加入足量硝酸银溶液:Ag++Cl-=AgCl↓ | |
| D. | 氯化铁溶液中加入氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com