
| A��0.1 mo1?L-1һ��ˮ�У�c��OH-��=c��NH4+�� |
| B���ڳ����£�10mL 0.02mo1?L-1��HCl��Һ��10mL0.02 mL mo1��L-1��Ba��OH��2��Һ ��ֻ�ϣ�����Ϻ���Һ�����Ϊ20mL������Һ��pH=11 |
| C����0.1 mol?L-1CH3COONa��Һ�У�c��OHһ��=c��CH3COOH��+c��H+�� |
| D��0.1 mo1?L-1ij��Ԫ����ǿ����NaHA��Һ�У�c��Na+��=2 c��A2-��+c��HA��+c��H2 A�� |
| 0.02mol/L��0.01L��(2-1) |
| 0.02L |
| KW |
| c(OH-) |
| 0.02mol/L��0.01L��(2-1) |
| 0.02L |
| KW |
| c(OH-) |


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
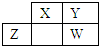 ���ֶ�����Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ�������ʾ��Y��Z������֮��Ϊ20������˵���в���ȷ���ǣ�������
���ֶ�����Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ�������ʾ��Y��Z������֮��Ϊ20������˵���в���ȷ���ǣ�������| A��X��Y��Z��W��Ϊ�ǽ���Ԫ�� |
| B��X��Y��W���⻯���У�Y���⻯��е���� |
| C��Z����������Y�������ӵ��Ӳ�ṹ��ͬ |
| D��WԪ�صļ����Ӱ뾶����ZԪ�صļ����Ӱ뾶 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2002��9��14���Ͼ���ɽ������һ����ȫ�����ش�Ͷ���������������ʳƷ��Ͷ���˶����--����ǿ�����¶����ж���������֪����ǿ�Ľṹ��ʽ��ͼ���йض���ǿ����ѧ�������Ǽ������İ������������˵����ȷ���ǣ�������
2002��9��14���Ͼ���ɽ������һ����ȫ�����ش�Ͷ���������������ʳƷ��Ͷ���˶����--����ǿ�����¶����ж���������֪����ǿ�Ľṹ��ʽ��ͼ���йض���ǿ����ѧ�������Ǽ������İ������������˵����ȷ���ǣ�������| A������ǿ�������� |
| B������ǿ������ |
| C������ǿ�����ں�SO2����������ж��� |
| D������ǿ�ķ���ʽΪC4H8N4S2O4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ܶȱ�Һ̬ˮ���ܶ�С������й� |
| B��DNA�еļ�����������ͨ�������ʵ�ֵ� |
| C��HCl������ˮ��CH4������ˮ��ԭ����HCl�Ǽ��Է��ӣ�CH4�ǷǼ��Է��� |
| D��ˮ���з����ߵķе㣬��Ҫ����Ϊ�����ڴ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH4��Cl2�ڹ��������·�Ӧ�IJ��������������� |
| B��CH3CH2OH��һ�ֿ���������Դ |
| C��������ϩ�ļӳɣ�������ϩʹ����KMnO4��Һ��ɫ����������ں���̼̼˫���й� |
| D�����ۺ���ά��ˮ������ղ��ﶼ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n��SO2��/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A����������������ܶȲ���ʱ��˵���÷�Ӧ�Ѵﵽƽ��״̬ |
| B����O2��ʾ0��4 min�ڸ÷�Ӧ��ƽ������Ϊ0.005 mol/��L?min�� |
| C���������¶ȣ���SO2�ķ�Ӧ���ʻ���ƽ�ⳣ��Kֵ������ |
| D��ƽ��ʱ��ͨ��18O2��ƽ�����ƣ��ٴ�ƽ��ʱ�����ʾ�����18O��O2��ת���ʼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ϊ����θ����࣬����NaHCO3�Ŀ���ҩ��HCO3-+H+=H2O+CO2�� |
| B��FeSO4��Һ������������4Fe2++O2+2H2O=4Fe3++4OH- |
| C����������Һ�м�������İ�ˮ��Al3++3OH-=Al��OH��3�� |
| D����Na2O2����H2O��Na2O2+H2O=2Na++2OH-+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������������������ |
| B��B��Si�ĵ縺����ֵ��� |
| C��BeCl2�����ӻ����Al Cl3�ǹ��ۻ����� |
| D��Li��N2��ȼ��������Li3N |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��46 g�Ҵ��к��еĻ�ѧ����Ϊ7 NA |
| B��1 mol OH- ��1 mol-OH���ǻ����к��е���������Ϊ 9 NA |
| C��22.4L����������NaOH��Һ��Ӧת�Ƶ�����ΪNA |
| D��0.1 mol?L-1 FeCl3��Һ�Ƴɽ��壬����Fe��OH��3������һ��С��0.1 NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com