
| A. | 73 | B. | 74 | C. | 75 | D. | 76 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 过渡元素是副族和第Ⅷ族元素的总称 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 性质 | 金刚石 | 石墨 |
| 外观 | 无色,透明固体 | 灰黑,不透明固体 |
| 沸点 | ? | ? |
| 熔点 | ? | ? |
| 燃烧热/kJ•mol-1 | 395.4 | 393.5 |
| A. | C(石墨,s)═C(金刚石,s)△H=+1.9kJ•mol-1 | |
| B. | 在相同条件下石墨的熔点应高于金刚石 | |
| C. | 金刚石中碳碳键键能大于石墨中碳碳键键能 | |
| D. | 在相同条件下石墨和金刚石的沸点应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}Cl$ | |
| B. | K2O的电子式: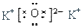 | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 比例模型 可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
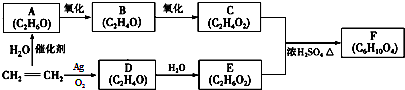
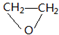 .
.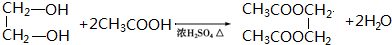 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
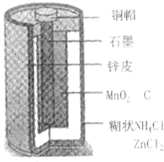 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 2.4gMg溶于足量稀盐酸,转移的电子数为0.1NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4gNH3中含有电子数为2NA | |
| B. | 0.1mol/L CuSO4溶液中含有的SO2-4数目为0.1NA | |
| C. | 常温常压下,2.24L O3中含有的氧原子数为0.3NA | |
| D. | 8.7gMnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的氯分子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com