
| A. | 在淀粉与稀硫酸共热后的溶液中,滴加银氨溶液,检验水解产物中的葡萄糖 | |
| B. | 纤维素在人体内可水解生成葡萄糖,进而被氧化为二氧化碳和水,释放能量 | |
| C. | 油脂的水解在碱性条件下可生产肥皂,在酸性条件下生成甘油和高级脂肪酸 | |
| D. | 蛋白质水解的最终产物是氨基酸;遇重金属盐则发生盐析,稀释后仍能溶解 |
分析 A、应在碱性条件下反应,先加入氢氧化钠溶液,再滴加银氨溶液;
B、人体不能消化纤维素;
C、油脂在碱性条件下和酸性条件下均能水解;
D、蛋白质遇重金属盐发生变性.
解答 解:A、应在碱性条件下反应,先加入氢氧化钠溶液,再滴加银氨溶液,然后水浴加热,才能有银镜,故A错误;
B、人体内没有使纤维素水解的酶,故人体不能消化纤维素,即纤维素在人体内不能水解为葡萄糖,故B错误;
C、油脂在碱性条件下水解为甘油和高级脂肪酸盐,可用于制造肥皂,故又称皂化反应;在酸性条件下能水解为甘油和高级脂肪酸,故C正确;
D、蛋白质遇重金属盐发生变性,遇浓的轻金属盐溶液发生盐析,蛋白质的盐析是可逆的,但变性不可逆,故D错误.
故选C.
点评 本题考查油脂及糖类、蛋白质的结构与性质等,比较基础,注意基础知识的掌握.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | SO2+H2O═H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | W的最高价氢氧化物的碱性比X弱 | D. | Y的最简单氢化物的稳定性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
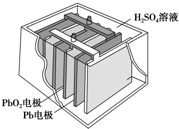 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | B. | SO42-向Pb极移动 | ||
| C. | PbO2得电子,被氧化 | D. | 电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
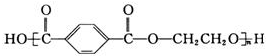 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 由单体合成该聚酯纤维的反应属于加聚反应 | |
| B. | 该聚酯纤维不能水解 | |
| C. | 该聚酯纤维单体为对苯二甲酸和乙二醇 | |
| D. | 该聚酯纤维含有亲水基羟基,在水中溶解度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
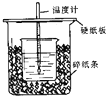 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com