
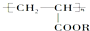 它属于( )
它属于( )| A. | ①③④ | B. | ①③⑤ | C. | ②③⑤ | D. | ②③④ |
分析 ①无机化合物通常指不含碳元素的化合物,但少数含碳元素的化合物,如二氧化碳、碳酸、碳酸盐等也属于无机物;
②通常把含碳元素的化合物叫做有机化合物,简称有机物.其组成中除含有碳外,还通常含有H、O、S、N、P等.有机物中一般含有碳元素,组成中含有碳元素的物质不一定是有机物;
③高分子化合物指相对分子质量一般在1万以上、一般具有重复结构单元的化合物;
④离子化合物是由阳离子和阴离子构成的化合物;
⑤主要以共价键结合形成的化合物,叫做共价化合物.
解答 解:聚丙烯酸酯的结构简式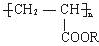 ,是含碳的化合物,属于有机物;相对分子质量很大,属于高分子化合物;是以共价键结合形成的化合物,属于共价化合物.
,是含碳的化合物,属于有机物;相对分子质量很大,属于高分子化合物;是以共价键结合形成的化合物,属于共价化合物.
故选C.
点评 本题以聚丙烯酸酯的结构为载体,考查高分子化合物、有机物、离子化合物的基本概念,难度较小,旨在考查学生对基础知识的掌握,注意基础知识的积累掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH值变小 | |
| B. | 醋酸的电离程度降低 | |
| C. | 溶液的导电能力减弱 | |
| D. | 中和此溶液所需的0.1mol/LNaOH溶液的体积增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
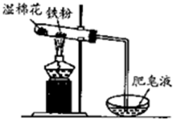
| A. | 试管中的铁粉用绕成团的细铁丝代替 | |
| B. | 将试管底部的湿棉花移到试管口部 | |
| C. | 将铁粉附着在石棉绒上,以增大与水蒸气的接触面积 | |
| D. | 点燃肥皂泡验证氢气的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量的新制氯水,溶液变色则有Br- | |
| B. | 加入酸性KMn04溶液,观察溶液颜色是否褪去 | |
| C. | 加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br- | |
| D. | 加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
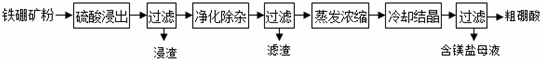
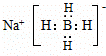 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 5 mol/L | D. | 1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石灰可用来做建筑材料以及中和酸性土壤 | |
| B. | 用水灭火的原理是降低了可燃物的着火点 | |
| C. | 用C、H2、CO都可以将CuO还原成Cu | |
| D. | 燃烧和缓慢氧化都是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com