


| ||
| ||


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY |
| B、若a=b,并测得c(X-)=c(Y-)+c(HY);则相同浓度时,酸性HX>HY |
| C、若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY |
| D、若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol?L-1,则可推出a+b=0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验方法 | 实验现象 | 结论 |
| ①证明氯和溴单质的氧化性强弱 | |||
| ②证明溴和碘单质的氧化性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
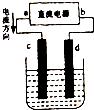 图是电解CuCl2溶液的装置,其中c、d为石墨电极.
图是电解CuCl2溶液的装置,其中c、d为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、K+、Cl-、SO42- |
| B、Mg2+、Na+、MnO4-、I- |
| C、H+、Al3+、CO32-、Cl |
| D、H+、Fe3+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com