
| A. | CH 4 | B. | C 2H 4 | C. | C 2H 6O | D. | C 6H 12O 6 |
分析 有机物完全燃烧消耗的氧气的多少不但与C、H原子数的多少有关,还与分子中氧原子数目有关,并且当有机物分子组成为Cn(H2O)m时,耗O2的物质的量与生成的CO2的物质的量相等,设有机物通式为CxHy,则1mol有机物完全燃烧,耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,据此计算判断..
解答 解:A.1molCH 4完全燃烧,生成1molCO2,耗氧量=(1+$\frac{4}{4}$)mol=2mol,故A错误;
B.1molC 2H 4完全燃烧,生成2molCO2,耗氧量=(2+$\frac{4}{4}$)mol=3mol,故B错误;
C.1molC 2H 6O完全燃烧,生成2molCO2,耗氧量=(2+$\frac{6}{4}$-$\frac{1}{2}$)mol=3mol,故C错误;
D.1molC 6H 12O 6完全燃烧,生成6molCO2,耗氧量=(6+$\frac{12}{4}$-$\frac{6}{2}$)mol=6mol,故D正确.
故选D.
点评 本题考查有机物燃烧耗氧量问题,题目难度不大,注意根据烃的燃烧通式解答.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:填空题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
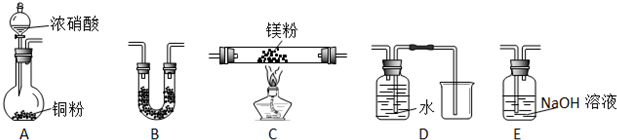
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
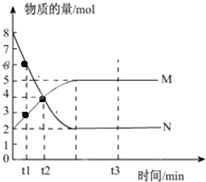 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过澄清石灰水 | |
| B. | 通过Ba(OH)2溶液再通过石灰水 | |
| C. | 通过酸性高锰酸钾溶液再通过石灰水 | |
| D. | 通过小苏打悬浊液再通过石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
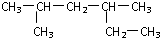 的名称是2,4-二甲基己烷
的名称是2,4-二甲基己烷 的名称是2-甲基-2-戊烯
的名称是2-甲基-2-戊烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com