
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 蔗糖和麦芽糖互为同分异构体,纤维素和淀粉也互为同分异构体 |
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | A、B的分子数之比为x:y | B. | A、B两种气体的密度之比为y:x | ||
| C. | A、B的摩尔质量之比为x:y | D. | A、B的物质的量之比为x:y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C3H8 | C. | C3H6 | D. | C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4•5H2O)为原料进行配制,请回答下列问题:
(1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4•5H2O)为原料进行配制,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
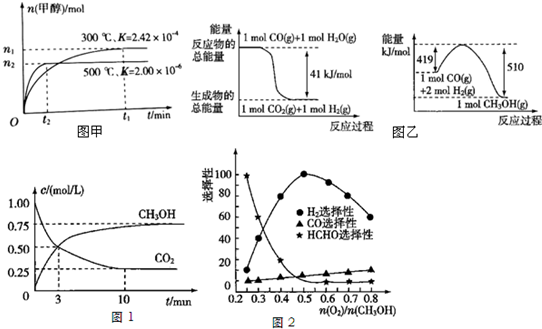
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com