
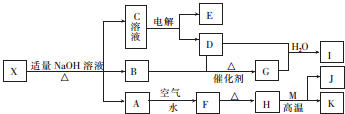
分析 据此离子方程式(AgNO3+NH4SCN=AgSCN↓+NH4NO3)中NH4SCN的量计算出,消耗AgNO3的质量,并求得,此反应(AgNO3+NH4Cl=AgCl↓+NH4NO3)消耗NH4Cl的量.
解答 解:n(NH4SCN)=0.05000mol/L×0.025L=0.00125mol
AgNO3+NH4SCN=AgSCN↓+NH4NO3
1 1
n 0.00125
$\frac{1}{n}=\frac{1}{0.00125}$,n=0.00125mol,
n总(AgNO3)=$\frac{50.00mL×0.0314g/mL}{170g/mol}$=0.00924mol
n1(AgNO3)=n总(AgNO3)-0.00125=0.00924-0.00125=0.00799mol
AgNO3+NH4Cl=AgCl↓+NH4NO3
1 1
0.00799 0.00799
m(NH4Cl)=$\frac{0.00799×53.5}{15%}$=2.85g.
答:含15%游离水的氯化铵试样2.85g.
点评 正确书写方程式是本题解题的关键,本题较为简单,但是计算稍微有点麻烦.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
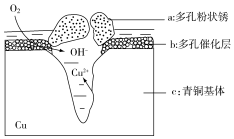 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极c被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
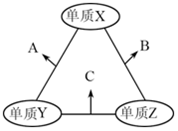 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: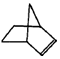
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com