
【题目】碱式氯化铝[Al2(OH)nCl6﹣n]是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果.其制备流程如下: 
(1)原料需要粉碎,其目的是;滤渣I的主要成分是;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,检验溶液中呈浅绿色的阳离子常采用加入溶液进行检验(填试剂化学式).
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是;已知碱式氯化铝的分散质粒子大小在1~100nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,用离子方程式解释其原因为;
(4)某温度下若0.1mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3胶体时,吸收热量Q kJ,该水解过程的热化学反应方程为
【答案】
(1)增大接触面积,加快溶解速率;Si02
(2)K3[Fe(CN)6]
(3)除Fe3+;观察是否有丁达尔效应;Al3++4OH﹣=AlO2﹣+2H2O
(4)AlCl3(aq)+3H2O(l)?Al(OH)3(胶体)+3HCl(aq)△H=+400QkJ∕mol
【解析】解:工业铝灰和活性铝矾土为原料(主要含Al、Al203、Si02及铁的氧化物),加入硫酸和盐酸,Si02不溶,Al、Al203及铁的氧化物溶解为离子,滤渣I为Si02 , 滤液调节PH,三价铁离子会转化为沉淀,则滤渣II为氢氧化铁,滤液II再经过蒸发浓缩,过滤得到硫酸钙和碱式氯化铝溶液.(1)有固体参加的反应,固体的表面积越大,反应速率越快,所以粉碎煤矸石能增大接触面积,加快溶解速率;二氧化硅不溶于酸,所以滤渣I为Si02;所以答案是:增大接触面积,加快溶解速率;Si02;(2)Fe2+在溶液中为绿色,可以用K3[Fe(CN)6];Fe2+易被空气中的氧气氧化为Fe3+ , 随后溶液又变为棕黄色,是因为Fe2+被空气中的氧气氧化为Fe3+ , 其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;
所以答案是:K3[Fe(CN)6];(3)Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;其次还可以除去铁离子,已知碱式氯化铝的分散质粒子大小在1nm100nm之间,则为胶体,滤液I为溶液,用一束光照射液体,观察是否有丁达尔效应,有丁达尔效应的是碱式氯化铝;Al3+与过量的强碱反应生成偏铝酸盐,所以若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为Al3++4OH﹣=AlO2﹣+2H2O;
所以答案是:除Fe3+;观察是否有丁达尔效应;Al3++4OH﹣=AlO2﹣+2H2O;(4)若0.1mol AlCl3在某温度下溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热量QkJ,则1mol完全反应水解吸收的热量为400QkJ,则其热化学方程式为:AlCl3(aq)+3H2O(l)Al(OH)3(胶体)+3HCl(aq)△H=+400QkJ/mol;
所以答案是:AlCl3(aq)+3H2O(l)Al(OH)3(胶体)+3HCl(aq)△H=+400QkJ∕mol.


科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H=0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05molL﹣1 . 则A的平均反应速率v(A)= . 该反应达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为(填“变大”、 “变小”或“不变”)
(3)判断反应是否达到平衡的依据为(填字母代号).
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50mol D,此时v正v逆(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制某植物营养液可补充氮、磷、钾元素,其成分及含量如表所示:
成分 | 含量 |
硝酸钙 | 260 |
硫酸钾 | 250 |
磷酸二氢铵 | 345 |
硫酸镁 | 537 |
硫酸铵 | 237 |
(1)补充钾元素的物质是 , 其电离方程式为 .
(2)该营养液若在碱性土壤使用,会使氮肥肥效降低,其原因是 .
(3)该营养液中磷元素的浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的氯化物是重要的化工原料,广泛地用作有机合成催化剂.
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如图1.
按要求回答下列问题:
(1)在进行操作①之前,要确认溶液中杂质已经完全沉淀,检验的具体操作和现象是 .
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是;
(3)溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号) .
a.NaHCO3 b.NH3H2O c.CuO d.Cu2(OH)2CO3
(4)现用如图2所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略).
①按气流方向连接各仪器接口顺序是:a→、→、→f、g→ .
②为了防止生成氧化铜,实验时在大试管加热前要进行一步重要操作,其操作是 .
③实验过程中,饱和食盐水中出现少许浑浊的现象,请用化学相关原理和知识解释原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中央电视台报道,继“食盐加碘”后,我国又将启动“酱油加铁”工程。“酱油加铁”的意义是( )
①补充人体需要的铁元素
②预防缺铁性贫血病
③改善酱油的味道
④增加黑色素
⑤减少厨房污染物
⑥提高人们的健康水平
A.①②③
B.④⑤⑥
C.③④⑤
D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素化合物在医药、纳米材料制备中应用广泛.
(1)P元素的基态电子电子排布式为
(2)白磷的分子式为P4 , 其结构如图1所示,科学家目前合成了 N4分子,N 原子的杂化轨道类型是 , N﹣N﹣N 键的键角为; 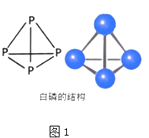
(3)N、P、As原子的第一电离能由大到小的顺序为 .
(4)HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 , 酸根中没有孤对电子的是 , NO2﹣价电子构型是 .
(5)立方氮化硼晶体的结构如图2所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是;立方砷化镓晶体的晶胞边长为a pm,则其密度为gcm﹣3(用含a的式子表示,设NA为阿伏伽德罗常数的值). 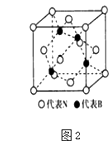
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
( )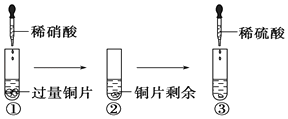
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,下图是利用手持技术得到的微粒物质的量变化图,常温下向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.下列说法正确的是( ) 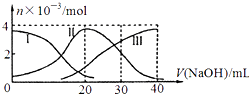
A.H2 A在水中的电离方程式是:H2A=H ++HA ﹣;HA ﹣═H++A2﹣
B.当V(NaOH)=20mL时,则有:c(Na + )>c(HA﹣ )>c(H + )>c(A 2﹣ )>c(OH﹣ )
C.当V(NaOH)=30mL时,则有:2c(H + )+c(HA﹣ )+2c(H2A)=c(A 2﹣ )+2 c(OH﹣ )
D.当V(NaOH)=40mL时,其溶液中水的电离受到抑制
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com