
分析 (1)2.0 mol/L Fe2(SO4)3溶液中Fe3+的物质的量浓度为4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,据此计算;
(2)标准状况下1.68LH2的物质的量为0.075mol,根据H原子守恒可知溶液中H+浓度减小为$\frac{0.075mol×2}{0.2L}$=0.75mol/L,最终溶液中H+物质的量浓度为$\frac{4×150×1{0}^{-3}mol}{0.2L}$mol/L-0.75mol/L=2.25mol/L,由此解答.
解答 解:(1)2.0 mol/L Fe2(SO4)3溶液中Fe3+的物质的量浓度为4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,混合后溶液中Fe3+的物质的量浓度c(Fe3+)=$\frac{4mol/L×50mL×1{0}^{-3}L/mL}{(150+50)×1{0}^{-3}L}$=1mol/L.
故答案为:1mol/L;
(2)标准状况下1.68LH2的物质的量为0.075mol,根据H原子守恒可知溶液中H+浓度减小为$\frac{0.075mol×2}{0.2L}$=0.75mol/L,最终溶液中H+物质的量浓度为$\frac{4×150×1{0}^{-3}mol}{0.2L}$mol/L-0.75mol/L=2.25mol/L,故答案为:2.25mol/L.
点评 本题考查物质的量浓度的计算,稀释定律和元素守恒等方法在解题中的应用,难度中等,注意守恒思想的运用.


科目:高中化学 来源: 题型:解答题
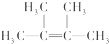 ;
;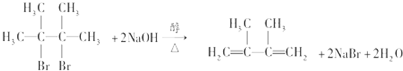 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若两种元素形成XY2型化合物,其中XY2若形成分子晶体,则XY2是非极性分子 | |
| B. | 若两种元素形成YX2型化合物,则YX2既可能形成原子晶体,也可能形成分子晶体 | |
| C. | 若两种元素可形成YX型化合物,则YX的晶体一定属于离子晶体 | |
| D. | 若两种元素可形成YX3型化合物,则YX3的水溶液可能呈强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
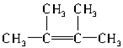 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023b2/n | B. | b2/n | C. | n/b2 | D. | 6.02×1023b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 三 | 一 | 五 | 二 | 六 | 四 |
 |  |  |  |  |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com