
����Ŀ��������һ�������·�������ת����ϵ��

��֪��������H�к���һ��������ش�
��1��д��B�ĵ���ʽ___��������D�еĹ���������___��
��2��E+H��G�Ļ�ѧ����ʽ��___��
��3������˵������ȷ����___��
A��������A��D����������Һ��Ӧ���ɹ���������
B�������Ƶ�������ͭ�������ֻ�����C��D��E
C����ͬ������A��E��H���ȼ��ʱ���ĵ���������
D��������F��G��Ϊͬ���칹��
���𰸡�![]() ȩ��
ȩ�� ![]() +CH3COOH
+CH3COOH![]() +H2O BD
+H2O BD
��������
������ϡ�����������ˮ�����������ǡ�C������������E�����������ǵ����ʿ���֪��CӦ��Ϊ�Ҵ���BΪ������̼���Ҵ���������D��DΪ��ȩ����ȩ������E��EΪ���ᡣH�ܺ����ᡢ�Ҵ�����������Ӧ��˵��H�к����Ȼ����ǻ���������֪������H�к���һ�����ͷ���ʽ��֪��HΪ![]() ��
��
��1���������ھƻ�ø�������������Ҵ��Ͷ�����̼��CΪ�Ҵ���BΪ������̼��������̼����ʽΪ![]() ��DΪ��ȩ���������Ϊȩ����
��DΪ��ȩ���������Ϊȩ����
��2��EΪCH3COOH��HΪ![]() �����߷���������Ӧ����ѧ����ʽΪ
�����߷���������Ӧ����ѧ����ʽΪ![]() +CH3COOH
+CH3COOH![]() +H2O��
+H2O��
��3��A�������Ǻ���ȩ�к���ȩ��������������Һ����������Ӧ�����ɹ��������������������⣬A����
B��C�Ҵ���������ͭ��Һ����Ӧ������D��ȩ�������Ƶ�������ͭ��Ӧ����ש��ɫ������E��������������ͭ��Ӧ�����ܽ�������ɫ��Һ�������߿������Ƶ�������ͭ���֣�ѡ��������⣬B��ȷ��
C��A��E��H�ķ������ʽ��ΪCH2O������ͬ������A��E��H���ȼ��ʱ��������������ͬ��ѡ��������⣬C����
D��������F��G�ķ���ʽ��ͬ�����߲���ͬ���칹�壬�������⣬D��ȷ��
��ѡBD��


 Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д� ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ�Ҳ����ȼ�ϡ���ҵ�Ͽ���CO2��H2��һ�������ºϳɼ״����ش��������⡣
(1)��֪��CO �� H2 ��ȼ���ȷֱ�Ϊ 283.0 kJ��mol-1��285.8kJ��mol-1 ��ˮ��������Ϊ 44.0kJ��mol-1�� ��Ӧ�� CO+H2O=CO2+H2 �����ɺϳɼ״���ԭ����(CO2��H2)����Ҫ��Ӧ�����Ȼ�ѧ����ʽΪ�� CO(g)+H2O(g)=CO2(g)+H2(g) ��H =_____ kJ��mol-1��
(2)ijͬѧ���ʵ��Է�Ӧ�ٽ����о����� 1mol H2O(g)�� 1mol CO ����һ�������ܱ������У��ڴ�����һ���¶��´ﵽ��ѧƽ�⡣��ͼ�� CO ��ƽ��ת����(%)���¶ȱ仯�����ߣ�260��ʱ��Ӧ�ٵ�ƽ�ⳣ�� K=_______��
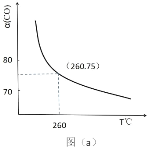
(3)CO2�� H2�ڴ�����һ���¶��ºϳɼ״���ͼΪ���ݻ�Ϊ 1L �ĺ����ܱ������У����� 3 molH2�� 1molCO2ʱ������ͬʱ��״������뷴Ӧ�¶ȵĹ�ϵ���ߣ�
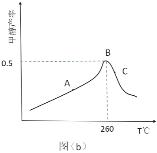
������ A ��_____(������������������)��Ӧ�¶��µ�ƽ����ʣ�������_____��C ��״��IJ��ʵ��� B ���ԭ�������_____(����)��
A.��Ӧ������� B.�������Ե� C.����Ӧ�� D.ƽ�ⳣ����� E.ƽ�������ƶ�
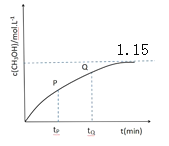
(4)CO�� H2��һ��������Ҳ���Ժϳɼ״������ݻ�Ϊ1L�ĺ����ܱ������У����� a molH2��2.0molCO���ڴ����� 260���¶������·�����Ӧ��CO+2H2=CH3OH��ͼΪ�״���Ũ���뷴Ӧʱ��Ĺ�ϵ���ߣ�tP ʱ�� v ��_____tQ ʱ�� v ��(����ڡ�С�ڻ����)���жϵ�������_____����ƽ��ʱ������Ũ��Ϊ 1.0mol/L������ʼʱ��������������ʵ���Ϊ_____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��ϵͳ��������������![]() ��������2��3��5��5���ļ���4��4�����һ�����
��������2��3��5��5���ļ���4��4�����һ�����
B.�����ʵ����ı��ͱ�������ȫȼ�������������������
C.���ͼױ���Ϊͬϵ�����ʹKMnO4������Һ��ɫ
D.�ṹƬ�� �ĸ߾���䵥���DZ��Ӻͼ�ȩ
�ĸ߾���䵥���DZ��Ӻͼ�ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A.28g��ϩ�ͻ���Ļ�������к��е�̼ԭ����Ϊ2NA
B.2.0gD2O�к��е�����������������ΪNA
C.�����£�5.6gFe�뺬0.2molHNO3����Һ������ã�����ʧȥ�ĵ�����Ϊ0.15NA
D.��1molCl-��NH4Cl��Һ�м���������ˮʹ��Һ�����ԣ���ʱ��Һ��NH4+��ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������õ�Ũ�ȵ�NaOH��Һ�ζ�25.00mL0.1000mol��L-1H2C2O4��Һ���յ㡣�ζ����̵õ���������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
��֪����Ka1(H2C2O4)=5.4��10-2 Ka2(H2C2O4)=5.4��10-5
����H2C2O4��Һ��c(��)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.����NaOH��Һ���Ϊ25.00mLʱ��c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7����Һ��c(Na+)=c(C2O42-)+c(HC2O4-)
C.��c(Na+)=2c(��)ʱ��c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol��L-1H2C2O4��Һ��c(H+)=0.1000mol��L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��ҩ��ϳɵ����м��壬��ͨ�����·����ϳɣ�

��1��B�й���������Ϊ__��
��2��G��H�ķ�Ӧ����Ϊ__��
��3����֪C��һ��ͬ���칹��Ϊ�� ������˵����ȷ����__��
������˵����ȷ����__��
a.�ܷ���������Ӧ
b.�ܷ���������Ӧ
c.1mol��������ȫˮ��������3molNaOH
d.�÷��ӵĺ˴Ź��������з����֮��Ϊ1��2��6��2
e.�������������µ�ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ
��4�� ������̼ԭ�Ӹ���Ϊ__��
������̼ԭ�Ӹ���Ϊ__��
��5��E�ķ�����ΪC14H17O3N��E����ԭ�õ�F��д��E��F�ķ�Ӧ����ʽ��__��
��6����֪����
�ڱ���(![]() �ױ�����
�ױ�����
���Լױ���(CH3CO)2OΪԭ���Ʊ� ��д���Ʊ��ĺϳ�·������ͼ(���Լ���ѡ)��__��
��д���Ʊ��ĺϳ�·������ͼ(���Լ���ѡ)��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ������ݣ�
�¶� | 25 |
|
|
ˮ�����ӻ� |
| a |
|
�Իش���������
(1)��![]() ����a______1��10-14�<����>����=��)��
����a______1��10-14�<����>����=��)��
(2)250Cʱ��ijNa2SO4��Һ��c(SO42-)=5��10-4mol/L��ȡ����Һ1mL��ˮϡ����10mL����ϡ�ͺ���Һ��![]() ��
��![]() ______��
______��
(3)��![]() �¶��²��ij��Һ
�¶��²��ij��Һ![]() ������Һ��______
������Һ��______![]() ������������������������
������������������������![]() ��
��![]() �����¶���
�����¶���![]() ��NaOH��ҺaL��
��NaOH��ҺaL��![]() ��
��![]() ��ҺbL��ϣ������û��Һ
��ҺbL��ϣ������û��Һ![]() ����a��b______��
����a��b______��
(4)ijͬѧ��0.1 mol��L��1��NaOH��Һ�ֱ�ζ�20.00 mL0.1 mol��L��1��HCl��Һ��0.1 mol��L��1��CH3COOH��Һ���õ���ͼ��ʾ�������ζ����ߣ���ش��й����⣺
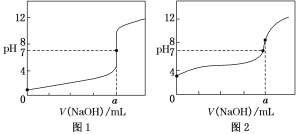
��0.1 mol��L��1��NaOH��Һ�ζ�0.1 mol��L��1��CH3COOH��Һ��������______(����ͼ1������ͼ2��)���ߡ�
��a��________��
(5)ijͬѧ��0.1 mol��L��1��NaOH��Һ�ֱ�ζ�20.00 mLδ֪Ũ�ȵ�HCl��Һѡ��_______��ָʾ������װ��Һ�ĵζ���δ��ϴ��ᵼ�²ⶨ���________������ƫ��������ƫ����������Ӱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ψһ����֬���ԵĹ��ᣬ��ҽҩ��ҵ������ͷ������Ѫ������ҩ����������������ҩ������ƥĪ�ֵȵ��м��壬Ҳ������������ʵ����������ԭ���Ʊ���

�ϳɱ������ʵ�鲽�衢װ��ʾ��ͼ������������£�
���� | ״̬ | �۵�/�� | �е�/�� | �ܽ��� |
������ | ��ɫ������ | 119 | 300 | ��������ˮ�����Ѻ������ |
���� | ��ɫ��Һ�� | -116.3 | 34.6 | ���ڵ�̼���������ȷ£�����ˮ |
����ȩ | ��ɫҺ�� | -26 | 179 | ����ˮ�������Ҵ������ѡ������ȷµȻ��� |
�ȷ� | ��ɫҺ�� | -63.5 | 61.3 | �����ڴ����ѡ�����������ˮ |
ʵ�鲽�裺

����һ������ͼ��ʾ��ʵ��װ���м���0.1mol(Լl0.1mL)����ȩ��0.2mol��Լ16mL���ȷ£��������뺬19g�������Ƶ���Һ��ά���¶���55��60�棬���貢������Ӧ1h������ӦҺ��pH�ӽ�����ʱ��ֹͣ��Ӧ��
�����������ӦҺ��200mLˮϡ�ͣ�ÿ����20mL������ȡ���Σ��ϲ��Ѳ㣬�����ա�
��������ˮ����50%�������ữ��pHΪ2��3����ÿ����40mL���ѷ�������ȡ���ϲ���ȡҺ������������ˮ�����ƣ��������ѣ��ôֲ�ƷԼ11.5g����ش��������⣺
(1)ͼ������C��������_________________��װ��B��������_____________
(2)����һ�к��ʵļ��ȷ�ʽ��_____________________��
(3)������������ѵ�Ŀ����_____________________��
(4)�������м���������ˮ�����Ƶ�Ŀ����_____________________��
(5)��ʵ��IJ���Ϊ____________��������λ��Ч���֣���
(6)�������ڸ߶˻�ѧ��Ҳ�к���Ҫ�����ã����Ա�������������Ϊԭ�ϣ��ڴ����Ĵ��¿ɺϳ����Բ�ּ�����������������д���÷�Ӧ�Ļ�ѧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2��һ�������ºϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H1�������ݻ���Ϊ1L��a��b��c��d��e����ܱ������зֱ����1molCO��2molH2�Ļ�����壬�����¶ȣ�����ʵ�飬������������ͼ��ͼ1���¶ȷֱ�Ϊ300�� ��500����ܱ������У��״������ʵ�����ͼ2���¶ȷֱ�ΪTl��T5���ܱ������У���Ӧ�����е�5minʱ�״������������������������ȷ����
CH3OH(g) ��H1�������ݻ���Ϊ1L��a��b��c��d��e����ܱ������зֱ����1molCO��2molH2�Ļ�����壬�����¶ȣ�����ʵ�飬������������ͼ��ͼ1���¶ȷֱ�Ϊ300�� ��500����ܱ������У��״������ʵ�����ͼ2���¶ȷֱ�ΪTl��T5���ܱ������У���Ӧ�����е�5minʱ�״������������������������ȷ����

A. �÷�Ӧ�ġ�H1>0����K1>K2
B. ������c�е�ƽ��״̬ת�䵽����d�е�ƽ��״̬,�ɲ�ȡ�Ĵ�ʩ�����»��ѹ
C. 300��ʱ����ƽ�����������ٳ���0.8molCO, 0.6molH2��0.2molCH3OH��ƽ�������ƶ�
D. 500��ʱ����ƽ�����������ٳ���1molCH3OH������ƽ���H2Ũ�ȺͰٷֺ���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com