
【题目】25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
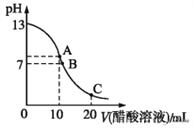
A. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-)
C. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 在C点: c(CH3COO-)+c(CH3COOH)=2c(Na+)
【答案】C
【解析】试题分析:
A、在C点,CH3COOH过量,以CH3COOH电离为主,溶液呈酸性,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A项正确;
B、B点时溶液pH等于7,为中性,c(OH-)=c(H+),由电荷守恒得c(CH3COO-)=c(Na+),故B项正确;
C、在A点是20mL0.1mol·L-1NaOH溶液和10mL0.2mol·L-1醋酸溶液恰好反应完全,生成的醋酸钠中的醋酸根离子水解使溶液呈碱性,离子浓度的关系应为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C项不正确;
D、在C点,由物料守恒可得c(CH3COO-)+c(CH3COOH)=2c(Na+),故D项正确。
考点:考查盐类的水解、离子浓度大小比较


科目:高中化学 来源: 题型:
【题目】原电池是将化学能转变为电能的装置。关于下图所示原电池的说法不正确的是
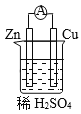
A. Cu为正极,Zn为负极 B. 电子由铜片通过导线流向锌片
C. 正极反应式为2H+ + 2e- ![]() H2↑ D. 原电池的反应本质是氧化还原反应
H2↑ D. 原电池的反应本质是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.2g铁粉投入40ml某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol,若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.3.5 mol/L
B.4.5 mol/L
C.7.0 mol/L
D.9.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。

(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
A. 氧化剂与还原剂的物质的量之比为1∶8
B. 氧化剂与还原剂的物质的量之比为5∶1
C. 氧化产物与还原产物的物质的量之比为5∶2
D. 氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=60mL)。下列叙述错误的是 ( )

A. 实验的环境温度低于22℃ B. 混合溶液的导电能力:M>N
C. P点混合溶液呈中性 D. 若将H2SO4改为CH3COOH,P点温度低于28℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,(已知硼氢化钠中氢为﹣1价),有关该电池的说法正确的是( ) 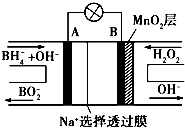
A.电极B材料中含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为6NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的HX,HY溶液,pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
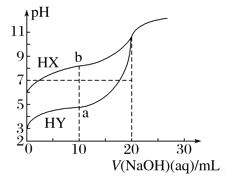
A. 当V(NaOH)=0 mL时,c(X-)>c(Y-)
B. a点时:c(Y-)+c(HY)=0.100 0 mol·L-1
C. b点时:c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+)
D. 当V(NaOH)=20.00 mL时,NaX、NaY两溶液中的阴离子总数相对大小:N前者>N后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com