
| A. | 无法计算 | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
分析 金属氧化物与硫酸反应生成硫酸盐和水,由反应CuO~CuSO4,Fe2O3~Fe2(SO4)3,FeO~FeSO4,可知H2SO4的物质的量等于金属氧化物中O元素的物质的量,据此计算金属氧化物中氧元素的质量,金属氧化物的质量减去氧的质量即为金属的质量.
解答 解:由反应CuO~CuSO4,Fe2O3~Fe2(SO4)3,FeO~FeSO4,可知H2SO4的物质的量等于金属氧化物中O元素的物质的量,
n(H2SO4)=1L×0.1mol/L=0.1mol,
所以金属氧化物中O的质量为0.1mol×16g/mol=1.6g,
若将mg原混合物在足量氢气中加热,使其充分反应,冷却后剩余固体为金属单质,
则金属质量为氧化物的质量减去氧的质量为(m-1.6)g,
故选D.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、原子守恒为解答的关键,侧重分析与计算能力的考查,注意H与O原子的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,H2是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
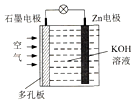 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )| A. | Zn电极是该电池的正极 | |
| B. | Zn电极的电极反应:Zn+H2O-2e-═ZnO+2H+ | |
| C. | OH-向石墨电极移动 | |
| D. | 氧气在石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热稀盐酸和MnO2的混合物 | |
| B. | 在KMnO4中加入NaCl和浓H2SO4并加热 | |
| C. | KCl加硫酸并加KClO2再加热 | |
| D. | 浓盐酸中加入浓H2SO4并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾”是微小水滴或冰晶组成的气溶胶系统 | |
| B. | “霾”中的灰尘对大气中的有害物质起吸附作用 | |
| C. | 雾霾中的二氧化硫、氮氧化物主要来自于化石燃料的燃烧 | |
| D. | 雾霾中的有机碳氢化合物主要来自于生物质的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、NO3-、K+、Cl- | B. | K+、Al3+、HCO3-、Cl- | ||
| C. | H+、Ca2+、HCO3-、Cl- | D. | Ca2+、HCO3-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物 质 | 加入试剂 | 有关化学方程式 |
| NaHCO3 (Na2CO3)(溶液) | ||
| MgO(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com