
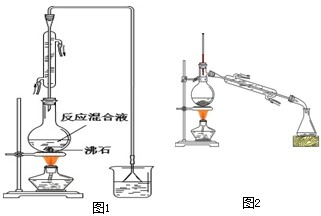
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度 g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、该混盐与硫酸反应产生1molC12时转移2NA个电子 |
| B、该混盐的水溶液呈碱性 |
| C、该混盐具有较强的氧化性 |
| D、该混盐中氯元素的化合价为+1和-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
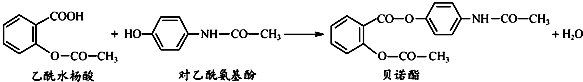
| A、1mol贝诺酯分子可与9mol H2完全反应 |
| B、可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C、贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| D、乙酰水杨酸和乙酰氨基酚均可与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
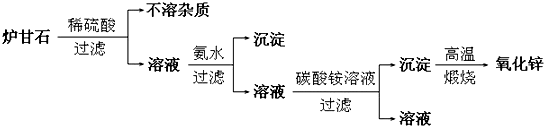
| 离子 | Fe3+ | Cu2+ | Zn2+ |
| 完全沉淀时的pH | 3.2 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 1 | 2 | 0 |
| 平衡浓度/mol/L | 0.6 | 1.6 | 0.8 |
| A、增大压强使平衡向生成Z的方向移动,平衡常数增大 | ||
B、反应可表示为X+Y?2Z,其平衡常数为
| ||
| C、反应达到平衡时,Y的转化率为20% | ||
| D、改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Vρ |
| M |
| M |
| NA△ |
| M |
| NA |
| V |
| NA |
| A、4个 | B、3 个 |
| C、2个 | D、1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com