
分析 (1)过氧化钠与水反应生成氢氧化钠和氧气;
(2)氯气和氢氧化钠溶液反应制备漂白液,生成氯化钠、次氯酸钠和水;
(3)根据强酸能制弱酸的规律来制取硅酸,可用盐酸和硅酸钠反应制取;
(4)氯气与水反应生成HCl、HClO,为氧化还原反应.
解答 解:(1)Na2O2和H2O生成NaOH和O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)在常温下,将氯气通入NaOH溶液中反应制备漂白液,生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;Cl2+2OH-=Cl-+ClO-+H2O;
(3)盐酸的酸性强于硅酸,可用盐酸制取硅酸,盐酸和硅酸钠溶液反应的化学方程式为:Na2SiO3+2HCl=2NaCl+H2SiO3↓,离子方程式为:SiO32-+2H+=H2SiO3↓,
故答案为:Na2SiO3+2HCl=2NaCl+H2SiO3↓;SiO32-+2H+=H2SiO3↓;
(4)氯气与水反应生成HCl、HClO,反应的化学反应方程式为:Cl2+H2O?HCl+HClO,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?HCl+HClO;Cl2+H2O?H++Cl-+HClO.
点评 本题考查离子方程式和化学方程式的书写,明确物质的性质及离子方程式的书写规则是解本题关键,单质、气体、沉淀、弱电解质、氧化物都写化学式,题目难度不大.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态 | |
| B. | 将钢闸门与直流电源的负极相连,可以防止钢闸门腐蚀 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al | |
| D. | 铅蓄电池在充电时,连接电源正极的电极上发生:PbSO4+2e-═Pb+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷燃烧的热化学方程式可表示为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5 kJ•mol-1 | |
| B. | 正丁烷燃烧的热化学方程式可表示为:2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);△H=-2878 kJ•mol-1 | |
| C. | 正丁烷转化为异丁烷的过程是一个放热过程 | |
| D. | 正丁烷比异丁烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
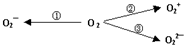

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
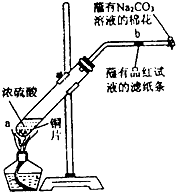 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
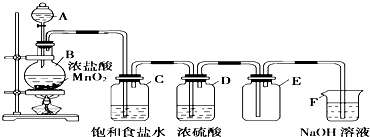
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
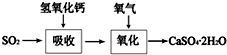 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com