
下列说法正确的是( )
A. 在测定中和热的实验中, 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
B. 酸碱中和滴定实验中,锥形瓶要用待装液预先润洗
C. 在测定中和热的实验中,用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D. 测溶液PH值时,PH试纸不能润湿
科目:高中化学 来源:2017届贵州省高三上月考三化学试卷(解析版) 题型:填空题
下列是铝的两种重要化合物的生产制备:
I.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe 、Mg杂质)制备明矾的过程如下图所示。
、Mg杂质)制备明矾的过程如下图所示。
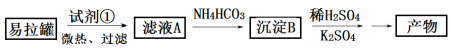
回答下列问题:
(1)为了少引入杂质,试剂①应选用___________(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)沉淀B的化学式为____________;将少量明矾溶于水,溶液呈弱酸性,其原因是______________。
II.以铝土矿(主要成分是Al2O3,杂质有SiO2、Fe2O3等)为原料,采用拜耳法生产Al2O3的流程如下图所示:
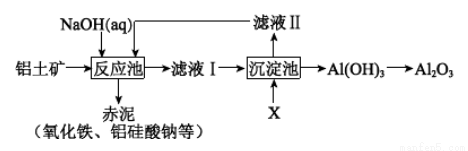
(1)Al2O3可用于电解制Al,其反应的化学方程式是______________________。
(2)调控反应池中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3溶于NaOH的离子方程式是_________________。
(3)该生产过程中,需向沉淀池中加入X。
① X 可为过量的CO2,则滤液II中主要的溶质是____________,为了使滤液II循环利用,应补充的物质是____________(选填字母);
a.CaO b.HCl c.Na2CO3
② X 也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
LED系列产品是被看好的一类节能新产品,下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是
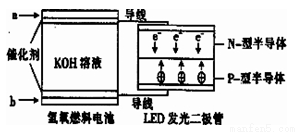
A.a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O
B.b处通入氧气,为电池的正极
C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
D.P-型半导体连接的是电池负极.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:实验题
实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定。
①称取WgNaOH固体试剂配制成100.00mL水溶液备用;
②将浓度为Cmol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度;
③取V1 mL NaOH待测溶液置于洁净的锥形瓶中,加入2-3滴甲基橙指示剂充分振荡,然后用浓度为C mol/L的标准盐酸滴定,用去盐酸V2 mL,试回答:
(1)如有1mol/L和0.1mol/L的标准盐酸应选用___________mol/L盐酸,原因是______________。
(2)滴定终点的判断 。
(3)若酸式滴定管尖嘴气泡未排出,会使碱测定值__________(偏大、偏小、无影响)。
(4)不用标准盐酸润洗酸式滴定管,会使碱测定值__________(偏大、偏小、无影响)。
(5)固体试剂NaOH纯度计算式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O  H+ + OH- ΔH>0 ,下列叙述正确的是( )
H+ + OH- ΔH>0 ,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量冰醋酸,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
已知H-H键能为436KJ/mol,H-N键能为391 KJ/mol,根据热化学方程式N2(g) +3H2(g) 2NH3(g) △H=-92.4kJ/mol。则N≡N的键能约为( )
2NH3(g) △H=-92.4kJ/mol。则N≡N的键能约为( )
A.431 kJ/mol B.946 kJ/mol C.649 kJ/mol D.896 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
对于任何一个化学平衡体系,以下变化或采取的措施,平衡一定发生移动的是( )
①加入一种反应物,②增大体系的压强,③升高温度,④使用催化剂,⑤化学平衡常数减小。
A.①②③⑤ B.①②③④⑤ C.③⑤ D.①②③
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考四化学卷(解析版) 题型:填空题
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同,F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式_____________________。
(2)A、B、C、D电负性由大到小的顺序为__________(填元素符号)。
(3 )F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ___ ,F与BD之间的作用力为 ______ 。
)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ___ ,F与BD之间的作用力为 ______ 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①由A、B、E三种元素构成某种新型储氢材料的理论结构模型如下图1所示,图中虚线框内B原子的杂化轨道类型有 ______ 种。

②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 _________ (填标号)。
A. H2O B. CH4 C. HF D. CO(NH2)2
③ F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如上图2所示,在晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为____ ;已知其摩尔质量为M g.mol-1 ,晶胞参数为a pm ,用NA表示阿伏加德罗常数,则该晶胞的密度为___________ g.cm-3。
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三上学期期中化学试卷(解析版) 题型:选择题
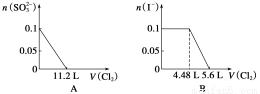
向含SO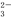 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的
、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的 关系图正确的是 ( )
关系图正确的是 ( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com