
| A、哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B、新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C、新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D、新催化剂降低了反应所需要的能量,使平衡正向移动 |


科目:高中化学 来源: 题型:
| A、先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则待测液中一定含有钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
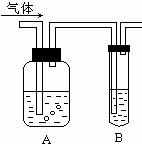 如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 澄清石灰水 |
| B | Cl2、HCl | 饱和NaCl溶液 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | CO2、HCl | 饱和NaHCO3溶液 | NaAlO2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
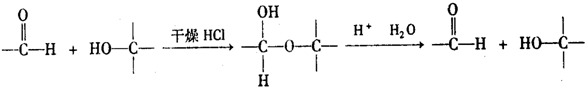
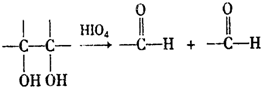
查看答案和解析>>
科目:高中化学 来源: 题型:
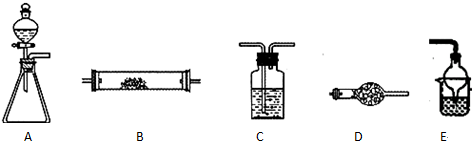
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、敞开体系,向FeCl2溶液滴加NaOH:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ |
| B、酸性 FeSO4 溶液中加 H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、硫代硫酸钠溶液中加入稀硫酸:2H++S2O3-=S↓+SO2↑+H2O |
| D、将氧气通入酸性碘化钾溶液中:2I-+O2+4H+=I2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com