
【题目】下列描述中正确的是( )
A.![]() 为V形的极性分子
为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中有7对完全相同的成键电子对
D.SiF4和SO32-的中心原子均为sp3杂化
【答案】D
【解析】
A. CS2的中心原子C的价层电子对数=2+![]() (4-2×2)=2,孤电子对数为0,因此几何构型为直线型,结构对称,正负电荷的中心重合,为非极性分子,故A错误;
(4-2×2)=2,孤电子对数为0,因此几何构型为直线型,结构对称,正负电荷的中心重合,为非极性分子,故A错误;
B. ClO3-中Cl的价层电子对数=3+![]() (7+1-3×2)=3+1=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
(7+1-3×2)=3+1=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C. SF6中一个S-F键含有一个成键电子对,SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,故C错误;
D. SiF4中Si的价层电子对数=4+![]() (4-4×1)=4,SO32-中S的价层电子对数=3+
(4-4×1)=4,SO32-中S的价层电子对数=3+![]() (6+2-3×2)=4,所以中心原子均为sp3杂化,故D正确;
(6+2-3×2)=4,所以中心原子均为sp3杂化,故D正确;
故答案为D。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用.
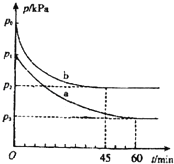
2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示.与实验a相比,实验b改变的条件是 ,判断的依据 .
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)SO3(g)+NO(g)△H=﹣42kJmol﹣1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= ,该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,Tl T2(填“>”“<’’或“=”),判断的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:______________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是__________________________;乙的作用是__________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。集气瓶中收集到的气体的主要成分是__________________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入________________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(s)![]() 3C (g) ΔH=-a kJ·molˉ1 (a>0)。下列说法正确的是
3C (g) ΔH=-a kJ·molˉ1 (a>0)。下列说法正确的是
A.当体系中 3v (A)=v (C)时,则反应达到化学平衡
B.达到化学平衡后,生成 1mol A 的同时消耗 2mol B
C.达到化学平衡后,反应放出的热量一定小于 a kJ
D.达到化学平衡后,保持容积不变并通入惰性气体,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物 ,下列叙述正确的是( )
,下列叙述正确的是( )
A. 分子间可形成氢键 B. 分子中既有极性键又有非极性键
C. 分子中有7个σ键和1个π键 D. 该分子在水中的溶解度小于2丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为芳香烃的衍生物,只含C、H、O三种元素,苯环上只有两种取代基,并且这两种取代基处于邻位,A的相对分子质量为164。A不能使![]() 溶液变色,但可被银氨溶液氧化为B;B能在浓
溶液变色,但可被银氨溶液氧化为B;B能在浓![]() 存在和加热条件下发生分子内的酯化反应生成C,C分子中除苯环外还有一个含氧的六元环(与苯环共用2个C原子)。
存在和加热条件下发生分子内的酯化反应生成C,C分子中除苯环外还有一个含氧的六元环(与苯环共用2个C原子)。
(1)B分子中的含氧官能团是________________________________________。
(2)A的苯环上两个取代基中的碳原子总数是(填数字)____________________。
(3)试写出其中的任意两种A及其对应的C的结构简式(请按对应关系分组填写)
第一组A__________________C___________________
第二组A___________________C___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液 X 中可能含有 Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-中的一种或几种,现取 X 溶液进行连续实验,实验过程及产物如下:
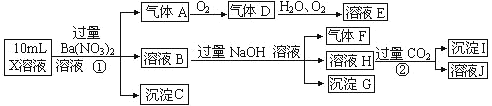
根据以上信息,下列判断正确的是
A.X 溶液中一定存在 A13+、NH4 + 、Fe3+、SO42-
B.X 溶液中可能存在 SO32-、C1-、NO2-
C.向溶液 J 中加入过量的溶液 E,最终溶液中可能含有两种溶质
D.沉淀 I 一定是 Al (OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列反应装置模拟侯氏制碱法制备NaHCO3,反应原理为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,下列说法错误的是( )
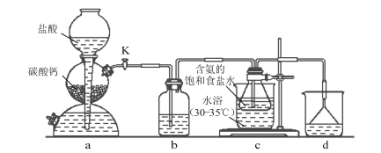
A.通过活塞K可控制CO2的流速
B.装置b、d依次盛装饱和Na2CO3溶液、稀硫酸
C.装置c中含氨的饱和食盐水提高了CO2吸收效率
D.反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期律,结合下列事实推测不合理的是()
事实 | 推测 | |
A | IVA族 | 同族 |
B | HI在230℃时分解,HCl在1500℃时分解 | HF分解温度大于1500℃ |
C | H3PO4是中强酸,H2SO4是强酸 | HClO4是强酸 |
D | Na、Al通常用电解法冶炼 | Mg可用电解法冶炼 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com