

| 2.627g |
| (96+58.7+18n)g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
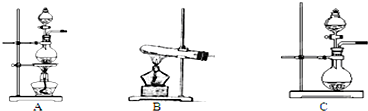
查看答案和解析>>
科目:高中化学 来源: 题型:
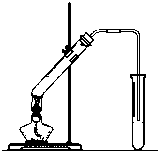 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行元素分析,测得粉末中K和S两种元素的质量比为39:16,则该粉末没有变质 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,则该粉末变质了 |
| C、将粉末加入盐酸中,产生气泡,则该粉末没有变质 |
| D、将粉末溶于水,滴加过量的盐酸,有气泡产生,再加入氯化钡溶液,有白色沉淀生成,则该粉末部分变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:7 | B、7:5 |
| C、1:2 | D、2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com