
 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
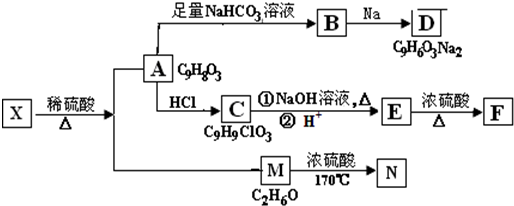
+H2O+CO2↑. 分析 A的分子式为C9H8O3,分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种,2个取代基处于对位,A遇FeCl3溶液发生显色反应,分子中含有酚羟基-OH,A能与碳酸氢钠反应,分子中含有羧基-COOH,A的不饱和度为$\frac{2×9+2-8}{2}$=6,故还含有C=C双键,所以A的结构简式为 ,X在浓硫酸、加热条件下生成A与M,M的分子式为C2H6O,M为乙醇,乙醇发生消去反应生成乙烯,N为乙烯,X为
,X在浓硫酸、加热条件下生成A与M,M的分子式为C2H6O,M为乙醇,乙醇发生消去反应生成乙烯,N为乙烯,X为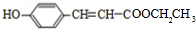 ,A与碳酸氢钠反应生成B,为
,A与碳酸氢钠反应生成B,为 ,B与Na反应生成D,D为
,B与Na反应生成D,D为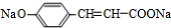 ,A与HCl反应生成C,C的分子式为C9H9ClO3,由A与C的分子式可知,发生加成反应,C再氢氧化钠水溶液中发生水解反应生成E,E在浓硫酸、加热的条件下生成F,F分子中除了2个苯环外,还有一个六元环,应发生酯化反应,故C为
,A与HCl反应生成C,C的分子式为C9H9ClO3,由A与C的分子式可知,发生加成反应,C再氢氧化钠水溶液中发生水解反应生成E,E在浓硫酸、加热的条件下生成F,F分子中除了2个苯环外,还有一个六元环,应发生酯化反应,故C为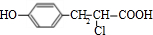 ,E为
,E为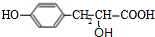 ,F为
,F为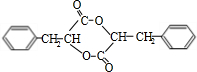 ,据此解答.
,据此解答.
解答 解:A的分子式为C9H8O3,分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种,2个取代基处于对位,A遇FeCl3溶液发生显色反应,分子中含有酚羟基-OH,A能与碳酸氢钠反应,分子中含有羧基-COOH,A的不饱和度为为$\frac{2×9+2-8}{2}$=6,故还含有C=C双键,所以A的结构简式为 ,
,
X在浓硫酸、加热条件下生成A与M,M的分子式为C2H6O,M为乙醇,乙醇发生消去反应生成乙烯,N为乙烯,X为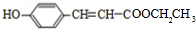 ,A与碳酸氢钠反应生成B,为
,A与碳酸氢钠反应生成B,为 ,B与Na反应生成D,D为
,B与Na反应生成D,D为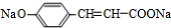 ,A与HCl反应生成C,C的分子式为C9H9ClO3,由A与C的分子式可知,发生加成反应,C再氢氧化钠水溶液中发生水解反应生成E,E在浓硫酸、加热的条件下生成F,F分子中除了2个苯环外,还有一个六元环,应发生酯化反应,故C为
,A与HCl反应生成C,C的分子式为C9H9ClO3,由A与C的分子式可知,发生加成反应,C再氢氧化钠水溶液中发生水解反应生成E,E在浓硫酸、加热的条件下生成F,F分子中除了2个苯环外,还有一个六元环,应发生酯化反应,故C为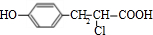 ,E为
,E为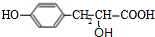 ,F为
,F为 ,
,
(1)由上述分析可知,有机物A为 ,分子中含氧官能团有:酚羟基和羧基,
,分子中含氧官能团有:酚羟基和羧基,
故答案为:酚羟基、羧基;
(2)E→F是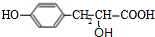 发生酯化反应生成
发生酯化反应生成 ,
,
故答案为:酯化反应;
(3) 与溴发生反应时,苯环羟基的邻位可以发生取代反应,C=C双键反应加成反应,故1molA可以和3mol Br2反应,
与溴发生反应时,苯环羟基的邻位可以发生取代反应,C=C双键反应加成反应,故1molA可以和3mol Br2反应,
故答案为:3;
(4)A→B的反应方程式为: +NaHCO3→
+NaHCO3→ +H2O+CO2↑,
+H2O+CO2↑,
故答案为: +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.
点评 本题考查有机物的推断,难度中等,是对有机物知识的综合考查,根据A的分子式及题目信息推断A的结构是解题的关键,能较好的考查学生分析、思维能力,是有机热点题型.


科目:高中化学 来源: 题型:选择题
| A. | 78 g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA | |
| C. | 常温常压下,28 g CO和N2的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,22.4 L H2S和SO2的混合气体中含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C中氢的质量分数约为4.5% | |
| B. | 0.352g该试样中氧元素的质量为0.192g | |
| C. | 利用该实验所得数据计算可得维生素C的分子式为C3H4O3 | |
| D. | 维生素C是一种抗氧化剂,俗称抗坏血酸,它在中性或碱性溶液中易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 氯气与H2O反应 Cl2+H2O═Cl-+2H++ClO- | |
| D. | 过量的CO2与Ca(ClO)2溶液反应:CO2+ClO-+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
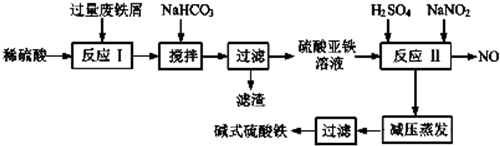
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
| A.酸性KMnO4溶液 B.KSCN溶液 | C.氯水 D.NaOH溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,其阴、阳离子的个数之比为1:2.
,其阴、阳离子的个数之比为1:2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com