
在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是(?? )
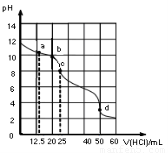
A.a点:c(CO32-)=c(HCO3-)>c(OH-)
B.b点:5c(Cl-)=4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3)
D.d点:c(Na+)<c(Cl-)
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.1 mol硫酸钾中阴离子所带电荷数为NA
B.常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA
C.在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+ 数等于NA
D.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com