
把等物质的量的CuSO4、FeCl3和锌粉置于足量的水中,充分反应,反应后的溶液中大量存在的金属阳离子是( )
A.Cu2+、Fe3+、Fe2+、Zn2+ B.Fe3+、Fe2+、Zn2+
C.Cu2+、Fe3+、Zn2 + D.Cu2+、Fe2+、Zn2+
科目:高中化学 来源:2017届广东省高三上学期摸底考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.39g K 与足量H2O反应完全后可生成NA个H2分子
B.含4 molHCl的浓盐酸和足量MnO2加热反应可生成NA个Cl2分子
C.标准状况下,22.4L 氟化氢中含2NA个原子
D.2mol单质Cu与足量高温硫蒸气完全反应,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源:2017届安徽省六安市高三上第一次月考化学试卷(解析版) 题型:填空题
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省六安市高三上第一次月考化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法正确的是
A.黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”, 其中的硝是指硝酸
B.包装食品里常有硅胶、生石灰、还原铁粉三类小包,其作用相同
C. 洪灾区民众用明矾净水并用漂白粉消毒,二者化学原理相同
D.家中做卫生保洁时,不可将“84”消毒液与洁厕精(含浓盐酸)混合使用
查看答案和解析>>
科目:高中化学 来源:2017届安徽省淮北市濉溪县高三上学期9月月考化学试卷(解析版) 题型:选择题
a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a:b不可能为( )
A.3:2 B.4:5 C.2:3 D.3:4
查看答案和解析>>
科目:高中化学 来源:2017届安徽省淮北市濉溪县高三上学期9月月考化学试卷(解析版) 题型:选择题
某学生想利用右图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2。下列说法正确的是 ( )

A.烧瓶是干燥的,由B进气,可收集②③④⑥⑦
B.烧瓶是干燥的,由A进气,可收集①⑤
C.在烧瓶中充满水,由A进气,可收集①⑤⑦
D.在烧瓶中充满水,由B进气,可收集⑥
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三上第二次检测化学试卷(解析版) 题型:填空题
电镀废水中常含有NaCN,工业上规定其含量低于0.5 mg/L才可排放,对NaCN超标的废水可用两段氧化法处理:
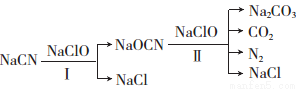
己知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同。
请回答下列问题:
(1)第一次氧化时,溶液的pH应调节为______(填“酸性”、“碱性”或“中性”);原因是___________。反应中,欲使1 mol NaCN变为NaOCN,则需要氧化剂NaClO至少为________mol。
(2)写出第二次氧化时发生反应的离子方程式:_____________________。反应中被氧化的元素是__________。
(3)处理10 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO__________g(实际用量应为理论值的4倍),才能使废水中NaCN含量达到排放标准。
查看答案和解析>>
科目:高中化学 来源:2017届河南省灵宝市高三上学期9月月考化学试卷(解析版) 题型:实验题
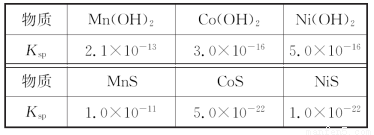
锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下,已知25℃,部分物质的溶度积常数如下:
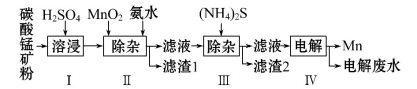
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是______________。
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是__________________,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是________。
(4)步骤Ⅳ中,在________(填“阴”或“阳”)极析出Mn,电极反应为___________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:选择题
铝在空气中能够稳定存在的原因是( )
A.铝的活泼性差 B.铝的还原性差
C.铝与氧气不反应 D.铝表面有致密的氧化膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com