
分析 (1)金属钠常保存在煤油中,是隔绝空气;
(2)碳酸钠与酸反应生成二氧化碳气体,来鉴别碳酸盐和氯化钠;
(3)C12与石灰乳反应生成次氯酸钙、氯化钙和水;漂白粉在空气中变质是因为其有效成分次氯酸钙与空气中的二氧化碳反应生成了次氯酸,并且次氯酸见光、受热分解,从而使漂白粉失效;
(4)根据化学反应,知道所有的Al共失电子6mol,所有的V原子共失电子是10mol,所以V2O5系数是3,V的系数是6,Al2O3的系数是5,金属Al的系数是10,V元素化合价下降,所以氧化剂是V2O5,3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V,由此分析解答.
解答 解;(1)金属钠常保存在煤油中,是隔绝空气,故答案为:隔绝空气,防止与空气中氧气和水蒸气接触发生反应;
(2)碳酸钠与酸反应生成二氧化碳气体,来鉴别碳酸盐和氯化钠,酸可用醋酸,故答案为:分别取少量未知的食盐和纯碱固体,然后分别加入食醋,有气泡冒出的是纯碱;
(3)C12与石灰乳反应生成次氯酸钙、氯化钙和水,化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;漂白粉中的次氯酸钙能与空气中的二氧化碳反应,反应原理为强酸制弱酸,方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑;
(4)根据化学反应,知道所有的Al共失电子6mol,所有的V原子共失电子是10mol,所以V2O5系数是3,V的系数是6,Al2O3的系数是5,金属Al的系数是10,V元素化合价下降,所以氧化剂是V2O5,3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V,生成1mol金属钒转移的电子总数为5NA,故答案为:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V;5NA.
点评 本题考查化学方程式的书写和金属铝以及化合物的性质以及计算,注意知识的归纳和整理是解题的关键,难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下用NaOH溶液吸收Cl2 | B. | Na在空气中燃烧 | ||
| C. | Na2O2吸收CO2 | D. | S在空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,所有元素的化合价都发生变化 | |
| B. | 氧化还原反应前后一定存在氧的得失 | |
| C. | 置换反应一定属于氧化还原反应 | |
| D. | 化合反应和分解反应不可能是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成0.1mol氧气,转移电子数为0.2NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中,含有的H+离子数为2NA | |
| C. | 常温常压下,1mol氦气含有的原子数为2NA | |
| D. | 标准状况下,11.2L水含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
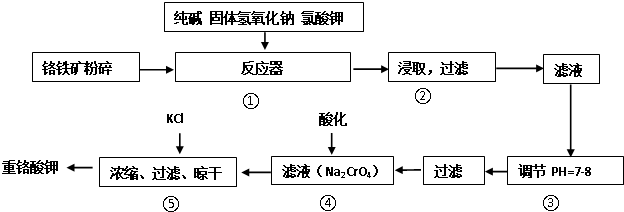
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
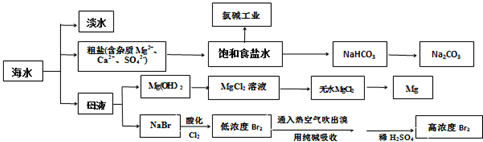
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| D. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维和计算机芯片的材料都是二氧化硅 | |
| B. | 蛋白质只含C、H、O、N四种元素 | |
| C. | 可用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| D. | 液溴易挥发,在存放液溴的试剂瓶中应加水“液封” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com